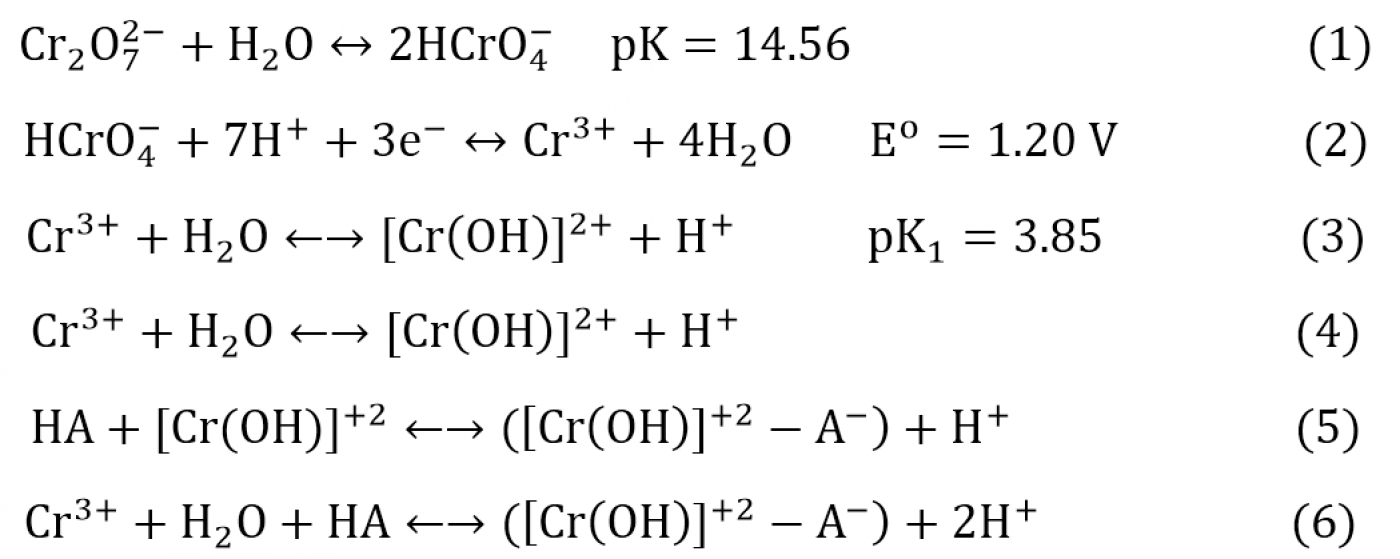کاربرد نانوجاذب ها در تصفیه آب-2

این مقاله شامل سرفصلهای زیر است:
1- مقدمه
2- نانوجاذبهای پایه کربنی
1-2- نانولولههای کربنی
2-2- گرافن و خانواده گرافن
1-2-2- کاربرد گرافن در حذف رنگ
2-2-2- کاربرد اکسید گرافن در حذف رنگ
3-2-2- کاربرد اکسید گرافن احیاشده در حذف رنگ
4-2-2- کاربرد گرافن در حذف عناصر سمی
نتیجهگیری
1- مقدمه
ورود بیرویه فلزات سنگین و رنگهای آلی بهمحیطزیست، به یک مشکل بزرگ جهانی تبدیل شده است. این آلایندهها از طریق فعالیتهای صنعتی، فاضلابهای خانگی و پسابها وارد آبهای طبیعی میشوند. انسان، عامل اصلی ورود آلایندهها به آب است. البته عوامل طبیعی از قبیل فرسایش خاک و سنگها در اثر هوا و آب باران نیز در ورود فلزات سنگین به آب مؤثر هستند. بنابراین، وجود این عوامل باعث ورود گونههای سمی به آب و سپس بدن موجودات زنده میشود. استفاده از فرآیند جذب یکی از روشهای مناسب برای حذف این آلایندهها از آب است. عدم نیاز به مقادیر زیاد انرژی، عدم نیاز به مواد شیمیایی جانبی، گستردگی و تنوع روش و توانایی حذف آلایندههای مختلف از جمله مزایای این روش هستند. در ادامه، جنبههای مختلف نانوجاذبهای متداول در صنعت تصفیه آب مطرح میشود.
2- نانوجاذبهای پایه کربنی
بهطور کلی، نانوجاذبهای پایه کربنی مورد استفاده در فرآیندهای تصفیه آب شامل نانولولههای کربنی، گرافن، اکسید گرافن و اکسید گرافن احیاشده است.
1-2- نانولولههای کربنی
نانولولههای کربنی بهدلیل داشتن خواص فیزیکی و شیمیایی منحصربهفرد موردتوجه قرار گرفتهاند. نانولولههای کربنی درشتمولکولهای استوانهایشکل با ساختمان بلوری هگزاگونال اتمهای کربن (مشابه با صفحات اتمی گرافیت) هستند. نانولولههای کربنی به دو دسته تکجداره و چندجداره تقسیمبندی میشوند. استحکام کششی فوقالعاده زیاد، مدول یانگ بالا، پایداری شیمیایی و حرارتی مناسب و رسانایی حرارتی و الکتریکی مطلوب از جمله ویژگیهای برجسته نانولولههای کربنی هستند. در زمینه مهندسی محیطزیست، نانولولههای کربنی بهدلیل برخورداری از ساختار توخالی بسیار متخلخل، سطح ویژه بالا، چگالی کم، گروههای عاملی سطحی و سطوح آبگریز، قادر به برهمکنشهای قوی با آلایندههای آلی و معدنی بوده و در نتیجه بهعنوان دسته جدیدی از نانوجاذبها برای تصفیه آلایندههای سمی شناخته شدهاند. بهطور کلی، چهار موقعیت مکانی برای جذب آلودگیهای مختلف روی کلاف نانولولههای کربنی وجود دارد:
(الف) مناطق داخلی: این مناطق در درون ساختار توخالی لولههای منفرد وجود دارند. دسترسی به این مکانها فقط با حذف کلاهک (رئوس) نانولولهها و انتهای باز لولهها امکانپذیر است.
(ب) کانالهای ایجادشده بین شکافها: این مکانها در فضای داخلی لولهها بین نانولولههای منفرد قرار دارند و بهراحتی با مواد آلاینده تماس مییابند.
(ج) شیارهای خارجی: شیارها معمولاً در پیرامون کلاف نانولوله کربنی و سطح خارجی نانولولههای بیرونی، جاییکه لولههای موازی بههم میرسند، قرار دارند.
(د) سطح بیرونی: مواد آلاینده میتوانند به سطوح انحنادار لولههای منفرد موجود در بیرون بستههای نانولولهها بچسبند.
مناطق مختلف جذب روی یک کلاف همگن نانولوله کربنی تکجداره با انتهای نیمهبسته در شکل 1 نشان داده شده است.
جذب روی نانولولههای کربنی با انتهای بسته، ابتدا در شیارهای بین لولههای مجاور کلاف رخ میدهد. سپس، جذب روی دیوارههای محدب خارجی انجام میگیرد. همچنین، در کلاف نانولوله کربنی باز، جذب در وهله اول توسط دیوارههای موجود درون نانولولههای باز صورت میگیرد. در این شرایط زنجیرههای یکبعدی در شیارهای موجود در سطح خارجی کلافها تشکیل میشوند. مرحله دوم شامل اشغال مناطق محوری باقیمانده درون نانولولهها و تکمیل تکلایههای شبههگزاگونال موجود روی سطوح خارجی کلافهاست. فرآیند جذب در مکانهای خارجی مانند شیارها و سطوح خارجی، بسیار سریعتر از مکانهای داخلی مانند کانالهای ایجادشده در لولهها و داخل لولهها صورت گرفته و به حالت تعادل میرسد.
کارایی نانولولههای کربنی در فرآیند جذب بستگی به چندین عامل مختلف مانند تعداد نانولولههای باز و بسته دارد. کلاف نانولوله کربنی باز ظرفیت جذب بیشتری نسبت به کلاف نانولوله کربنی بسته دارد. در کلافهای نانولوله کربنی باز، سینتیک جذب تسریع شده و قابلیت اشباع افزایش مییابد. همچنین، نانولولههای کربنی معمولاً با ناخالصیهایی مانند ذرات کاتالیست با پوشش کربن، دوده و شکلهای دیگر کربن مخلوط میشوند. حضور این ناخالصیها بهطور قابلتوجهی باعث کاهش بازده جذب آنها میشود. روشهای مختلفی مانند عملیات اسیدی، عملیات حرارتی و غیره برای حذف این ناخالصیها مورد استفاده قرار میگیرد. امکان افزایش خاصیت جذب نانولولههای کربنی با عاملدارکردن سطح آنها وجود دارد. گروههای عاملی موجود در سطح نانولولهها شامل گروههای عاملی هیدروکسیل (OH-)، کربونیل (CO-) و کربوکسیل (COOH-) میشود که طی فرآیند سنتز و خالصسازی یا بهطور خودبهخودی توسط اکسیداسیون اسیدهای مختلف، اُزن یا پلاسما تشکیل میشوند. این گروههای عاملی باعث اصلاح خاصیت ترشوندگی سطوح نانولولههای کربنی و تغییر سطوح آبگریز آنها به سطوح آبدوست میشود. در این شرایط، نانولولههای کربنی توانایی جذب ترکیبات قطبی و مواد با وزن مولکولی نسبتاً کم را خواهند داشت. همچنین، با تشکیل گروههای عاملی در سطح نانولولههای کربنی، مقاومت آنها در برابر نفوذ افزایش یافته و مساحت سطح فعال آنها کاهش مییابد. این عوامل باعث کاهش تمایل سطح نانولولههای کربنی به برهمکنش و جذب برخی از مواد شیمیایی آلی میشود. علاوهبراین، حضور گروههای عاملی منجر به قطع دسترسی به فضای داخلی نانولولههای بدون کلاهک میشود. بهمنظور حذف گروههای عاملی شیمیایی برای مشارکت فضای داخلی نانولولهها در فرآیند جذب، از عملیات حرارتی در محیط خلأ استفاده میشود.
بهطور کلی، استفاده از نانولولههای کربنی برای تصفیه آب نتایج امیدبخشی ارائه کرده است. این نانوجاذبها توانایی حذف حدود 99-80 درصد از آلودگیهای معدنی موجود در آب، با غلظت فلزات در محدوده 60-0/1 میلیگرم بر لیتر را دارند. پس از استفاده از این نانوجاذبها، امکان بازیابی و استفاده مجدد آنها بدون کاهش کارآیی، با انجام عملیات احیا توسط سدیم هیدروکسید (NaOH) وجود دارد. با بهکارگیری عملیات بازیابی، هزینههای عملیات تصفیه آب و پساب بهوسیله جاذب نانولولههای کربنی بهشدت کاهش مییابد.
علیرغم مزایای زیاد استفاده از نانولولههای کربنی بهعنوان نانوجاذب، کاربرد این نانولولهها در فرآیند تصفیه آب در سراسر جهان هنوز هم با محدودیتهایی مواجه است. محدودیت اصلی در این زمینه، هزینه بسیار بالای تولید نانولولههای کربنی است. با وجود هزینه کمتر تولید نانولولههای کربنی چندجداره نسبت به نانولولههای کربنی تکجداره، تولید نانولولههای کربنی چندجداره یک فرآیند گرانقیمت بهشمار میرود. هزینه تولید نانولولههای کربنی در مقایسه با کربن فعال دانهای حدود 1000 برابر بالاتر است. بنابراین، استفاده از نانولولههای کربنی در مقیاس صنعتی از لحاظ اقتصادی مقرونبهصرفه نیست. با این حال، قابلیت نانولولههای کربنی در حذف آلایندههای موجود در آب مانند میکروسیستین (microcystins) بسیار بیشتر از کربن فعال دانهای است و بازیابی نانولولهها باعث کاهش هزینههای استفاده از آنها در فرآیند تصفیه آب میشود. لازم به ذکر است که تلاشهای بسیاری برای تولید و توسعه نانولولههای کربنی چندجداره ارزانقیمت صورت گرفته است. بهعنوان مثال، برای تولید نانولولههای کربنی مقرونبهصرفه، از سنتز نانوساختارهای کربن گرافیتی با استفاده از پیرولیز نانولولههای پلیپیرول استفاده شده است که علاوه بر صرفه اقتصادی، سنتز آن از لحاظ زیستمحیطی نیز بیخطر است.
همانطوری که اشاره شد، نانولولههای کربنی گزینه آیندهداری برای حذف فلزات سنگین و عناصر سمی از آب محسوب میشود. بهعنوان مثالی از حذف یونهای فلزی موجود در آب هنگام تصفیه آن، واکنشهای شیمیایی طی برهمکنش نانولولههای کربنی با یونهای کروم بهصورت زیر گزارش شده است:
فرآیند جذب کروم از آب شامل دو مکانیزم اصلی است که مکانیزم اول در معادلات (1) تا (3) و مکانیزم دوم در معادلات (4) تا (6) نشان داده شده است. براساس معادلات ارائهشده، فرایند تبادل یونی نقش کلیدی در جذب و نگهداری یونهای فلزی از آب توسط نانوجاذب دارد. عامل اصلی کاهش HCrO4 به کروم فلزی در معادله (2)، وجود گروههای کربوکسیل و هیدروکسیل در سطح نانولولههای کربنی است که نقش دهنده الکترون در محلول را ایفا میکنند. دلیل غالببودن مکانیزم تبادل یون حین جذب فلزات سنگین با نانولولههای کربنی، برهمکنشهای کولنی جذب بین عوامل الکتروندهنده گروههای عاملی اکسیژندار روی سطح نانولولههای کربنی، با عوامل الکترونگیرنده روی یونهای فلزات سنگین است.
از نانولولههای کربنی برای جذب و حذف رنگهای آلی مانند سافرانین، اسید قرمز، متیل نارنجی، متیلن بلو، جوهر روناس، مورین و غیره از آب استفاده میشود. شرایط ترمودینامیکی، سینتیکی و اجرایی تعدادی از تحقیقات انجامشده در زمینه حذف رنگهای مختلف از آب با استفاده از انواع نانولولههای کربنی در جدول 1 آورده شده است.
جدول 1- شرایط ترمودینامیکی، سینتیکی و اجرایی تعدادی از پژوهشهای انجامشده در زمینه حذف رنگهای مختلف از آب با استفاده از انواع مختلف نانولولههای کربنی.
| جاذب | رنگ هدف | غلظت(mg/L) | pH | دما(K) | زمان تماس(h) | توانایی جذب(mg/g) | ایزوترم | مدل سینتیکی | ترمودینامیک |
| نانولوله کربنی | متیلن بلو | 5-40 | 7/0 | 273 298 333 |
1/5 | 35/4 46/2 64/7 |
لانگمویر | شبه درجه دوم | گرماگیر |
| نانولوله کربنی تکجداره | اسید قرمز 18 |
25-100 | 3/0 | 298 | 6 | 166/66 | لانگمویر | شبه درجه دوم | – |
| نانولوله کربنی تک جداره | باز قرمز46 | 50-200 | 9/0 | 298 308 318 328 |
3 | 38/38 33/12 30/12 27/16 |
لانگمویر | شبه درجه دوم | گرمازا |
| نانولوله کربنی تک جداره | زرد مستقیم86 | – | – | 288 308 328 |
4 | 35/8 54/9 56/2 |
فرویندلیچ | شبه درجه دوم | گرماگیر |
| نانولوله کربنی تک جداره | زرد مستقیم224 | – | – | 288 308 328 |
4 | 47/2 52/1 61/3 |
دوبینین-رادوشکویچ | شبه درجه دوم | گرماگیر |
| نانولوله کربنی تک جداره | پروسیون قرمز MX-5B |
20 | 6/5 | 281 291 301 321 |
24 | 42/92 44/64 39/84 35/71 |
لانگمویر، فرویندلیچ | شبه درجه دوم | گرماگیر |
| نانولوله کربنی تک جداره | متیلنبلو | – | 6/0 | 298 | 2 | 59/7 | لانگمویر، فرویندلیچ | شبه درجه دوم | – |
2-2- گرافن و خانواده گرافن
گرافن جدیدترین عضو خانواده دگرشکلهای کربن بهشمار میرود. گرافن یک لایه اتمی کربن با هیبریداسیون sp2 است که بهطور منظم در دو بعد گسترده شده است. شمایی از ساختار گرافن و سلول واحد آن در شکل 2 نشان داده شده است. هر سلول واحد شامل دو اتم است که هر کدام از اتمها به یک زیرشبکه (sub-lattice) تعلق دارند.
بهطور کلی، خانواده نانوجاذبهای پایه گرافن شامل گرافن، اکسید گرافن و اکسید گرافن احیاشده و نانوکامپوزیتهای پایه گرافن است. گرافن بهدلیل برخورداری از ویژگیهای منحصربهفرد مانند نانوساختار بینقص کربن با هیبریداسیون sp2، سطح ویژه بزرگ و برهمکنشهای قوی با سایر اتمها و مولکولها گزینه جذاب و آیندهداری برای جذب و حذف انواع آلودگیهای مضر همچون رنگها، عناصر سمی و آلایندههای آلی از سیستمهای آبی بهشمار میرود.
فرآیندهای انجامشده در صنایع نساجی سبب ورود آلودگیهای رنگی به آب میشود که مشکلات زیستمحیطی شدیدی را به همراه دارد. نانوجاذبهای سنتزشده از گرافن و خانواده گرافن برای حذف این آلایندهها بسیار مناسب و کارآمد هستند. در ادامه به تشریح تعدادی از فرآیندهای جذب و حذف رنگها با استفاده از نانوجاذبهای گرافنی پرداخته میشود.
1-2-2- کاربرد گرافن در حذف رنگ
از گرافن برای حذف متیلن بلو از محلول آبی استفاده شده است. با افزایش دما از 293 تا 330 درجه کلوین، بازده جذب آلاینده افزایش پیدا میکند. همچنین، در شرایط کاری ایدهآل، امکان حذف حدود 99.68 درصد از متیلن بلوی موجود در آب با استفاده از نانوجاذب گرافن وجود دارد. مشاهده شده است که مقدار متیلن بلوی جذبشده بهشدت به غلظت اولیه آن و مقدار تعادلی قابلدستیابی پس از گذشت یک ساعت از فرآیند بستگی دارد. شرایط ترمودینامیکی، سینتیکی و اجرایی تعدادی از پژوهشهای انجامشده در زمینه حذف رنگهای مختلف از آب با استفاده از اکسید گرافن در جدول 2 نشان داده شده است.
جدول 2- شرایط ترمودینامیکی، سینتیکی و اجرایی تعدادی از پژوهشهای انجام شده در زمینه حذف رنگهای مختلف از آب با استفاده از اکسید گرافن.
| جاذب | رنگ هدف | غلظت(mg/L) | pH | دما(K) | زمان تماس(h) | ظرفیت جذب(mg/g) | ایزوترم | مدل سینتیکی | ترمودینامیک |
| گرافن | کاتیونیک قرمز | 20-140 | – | 288 313 333 |
24 | 217/39 237/37 238/10 |
لانگمویر | شبه درجه دوم | گرماگیر |
| گرافن | متیلن بلو | 20-120 | – | 293 313 333 |
– | 153/85 185/19 204/08 |
لانگمویر | شبه درجه دوم | گرماگیر |
| گرافن | متیلن بلو | 5 | – | 303 | 96 | 1520 | – | – | – |
| اسفنج گرافن | متیلن بلو | 2 x 10-4 (مول بر لیتر) |
– | 298 | 4 | 184 | – | – | – |
| اسفنج گرافن | Bرودامین | 2 x 10-4 (مول بر لیتر) |
– | 298 | 4 | 72/5 | – | – | – |
| اسفنج گرافن | متیل اورانژ | 2 x 10-4 (مول بر لیتر) |
– | 298 | 24 | 11/5 | – | – | – |
| اکسید گرافن | متیلنپلو | -1/000 0/188 (گرم بر لیتر) |
6/0 | 298 | 1 | 714 | فرویندلیچ | – | – |
| اکسید گرافن | متیل بلو | -3/3 0/33 |
7/0 | 293 | 2 | 1/939 | لانگمویر | – | – |
| اکسید گرافن | متیل بلو | 10-50 | 10/0 | – | – | 17/3 | لانگمویر | شبه درجه دوم | – |
| اکسید گرافن | متیل بنفش | 10-50 | 3/0 | – | – | 2/47 | لانگمویر | شبه درجه دوم | – |
2-2-2- کاربرد اکسید گرافن در حذف رنگ
از اکسید گرافن نیز مانند گرافن در حذف رنگهایی همچون متیلن بلو و متیل بنفش استفاده میشود. استفاده از اکسید گرافن بازده بیشتری در حذف متیلن بلو نسبت به متیل بنفش دارد. با این وجود، بهدلیل وجود دو گروه سولفونیکی در نارنجی متیل، بار منفی در آن به وجود آمده و دافعه الکترواستاتیک بین نانوجاذب و نارنجی متیل باعث میشود که نانوجاذب اکسید گرافن بازده مطلوبی در حذف آن از آب نداشته باشد. با افزایش pH و استحکام یونی، بازده حذف رنگ از آب با استفاده از اکسید گرافن افزایش مییابد. همچنین، با کاهش دما و حضور مواد آلی محلول، فرآیند جذب با اکسید گرافن بهبود مییابد.
3-2-2- کاربرد اکسید گرافن احیاشده در حذف رنگ
اکسید گرافن احیاشده همانند دیگر اعضای خانواده نانوجاذبهای گرافنی، یک گزینه مناسب برای حذف رنگهایی همچون رنگهای اسیدی و نارنجی از محلولهای آبی محسوب میشوند. برخلاف اکسید گرافن، بازده حذف نارنجی از محلول آبی توسط نانوجاذب اکسید گرافن احیاشده نزدیک 95% است.
4-2-2- کاربرد گرافن در حذف عناصر سمی
در سالهای گذشته، مقدار عناصر سمی مانند مس، کروم، کادمیوم و آرسنیک موجود در آب بهدلیل تخلیه بدون کنترل آلایندهها و پسماند صنعتی حاصل از صنایع آبکاری، معدن، خودروسازی و غیره بهطور چشمگیری افزایش پیدا کرده است. نانوجاذبهای سنتزشده از نانوصفحات گرافنی از بازده بسیار مطلوبی در حذف یون سرب دوظرفیتی از محلول آبی برخوردار هستند. نرخ جذب و حذف سرب از محلول آبی بهشدت به غلظت اولیه یونهای سرب در آن بستگی دارد؛ بهطوری که با افزایش غلظت آنها نرخ حذف کاهش مییابد. همچنین، با انجام عملیات حرارتی روی نانوصفحات گرافنی و افزایش pH، مقدار یونهای سرب جذبشده افزایش مییابد. با برهمکنش گرافن و سرب، یک ترکیب کمپلکس طی واکنش لوییس اسید-باز (Lewis acid-base reaction) تشکیل میشود که در آن گرافن نقش باز لوییس، و فلز نقش اسید لوییس را ایفا میکنند. دلیل افزایش جذب با انجام عملیات حرارتی روی نانوصفحات گرافنی، حذف گروههای عاملی اکسیژندار و تقویت جاذبه الکترواستاتیک است. در شرایط بهینه، امکان حذف 99.5 درصد از سرب موجود در آب با استفاده از نانوجاذب گرافنی وجود دارد.
از نانوجاذب اکسید گرافن برای جذب اورانیوم ششظرفیتی از محلولهای آبی استفاده میشود. بازده حذف اورانیوم با نانوجاذب اکسید گرافن بهشدت به مقدار pH بستگی دارد؛ بهطوریکه بیشینه مقدار جذب در pH در بازه 4-2 رخ میدهد. ایزوترم جذب مطابق با مدل لانگمویر بوده و دارای ماهیت گرماگیر است. همچنین، از نانوجاذب اکسید گرافن برای جذب مس دوظرفیتی با بازده حدود 74% استفاده شده است. قدرت جذب عناصر سمی از آب توسط نانوجاذب اکسید گرافن بهصورت زیر است:
سرب > کادمیوم > روی > مس
نتیجهگیری
نانوجاذبها بهدلیل برخورداری از سطح ویژه بالا و خواص فیزیکی و شیمیایی منحصربهفرد گزینه جذاب و آیندهداری برای استفاده در فرآیند تصفیه آب محسوب میشوند. در این مقاله، به معرفی نانوجاذبهای پایه کربنی مانند نانولولههای کربنی، گرافن، اکسید گرافن و اکسید گرافن احیاشده بهعنوان نانوجاذبهای متداول در فرآیند تصفیه آب پرداخته شد. نانولولههای کربنی بهدلیل برخورداری از ساختار توخالی بسیار متخلخل، سطح ویژه بالا، چگالی کم، گروههای عاملی سطحی و سطوح آبگریز بهعنوان دسته جدیدی از جاذبها برای تصفیه آلایندههای سمی شناخته شدهاند و قادر به برهمکنشهای قوی با آلایندههای آلی و معدنی هستند. مناطق جذب روی یک کلاف نانولوله کربنی شامل مناطق داخلی، کانالهای ایجادشده بین شکافها، شیارهای خارجی و سطح بیرونی است. فرآیند جذب در مکانهای خارجی مانند شیارها و سطوح خارجی، بسیار سریعتر از مکانهای داخلی مانند کانالهای ایجادشده و داخل لولهها انجام گرفته و به حالت تعادل میرسد. کلافهای باز نانولوله کربنی توانایی جذب بیشتری نسبت به نانولولههای بسته دارند. با وجود مزایای استفاده از نانولولههای کربنی بهعنوان نانوجاذب، کاربرد آنها در فرآیند تصفیه آب کماکان با محدودیتهایی مواجه است که از مهمترین آنها میتوان به هزینه بسیار بالای تولید اشاره کرد. با بازیابی نانولولههای کربنی، هزینه تصفیه آب و پساب با استفاده از این نانوجاذبها بهشدت کاهش مییابد. از نانولولههای کربنی برای جذب و حذف رنگهای آلی مانند سافرانین، اسید قرمز، نارنجی متیل، متیلن بلو، جوهر روناس، مورین و غیره از آب استفاده میشود. گرافن بهدلیل برخورداری از ویژگیهای منحصربهفرد مانند نانوساختار بینقصی از کربن با هیبریداسیون sp2، سطح ویژه بزرگ و برهمکنشهای قوی با سایر اتمها و مولکولها گزینه جذاب و آیندهداری برای جذب و حذف انواع آلودگیهای مضر از سیستمهای آبی همچون رنگها، عناصر سمی و آلایندههای آلی بهشمار میرود.