مواد نانومتخلخل-بخش دوم

این مقاله شامل سرفصلهای زیر است:
1- مقدمه
2- نانوساختارهای متخلخل و شیمی اَبَرمولکولی (Supramolecular Chemistry)
3- معرفی برخی از متداولترین ترکیبات متخلخل
1-3- کربن فعال
2-3- چارچوبهای فلزی-آلی
3-3- زئولیتها
نتیجهگیری
1- مقدمه
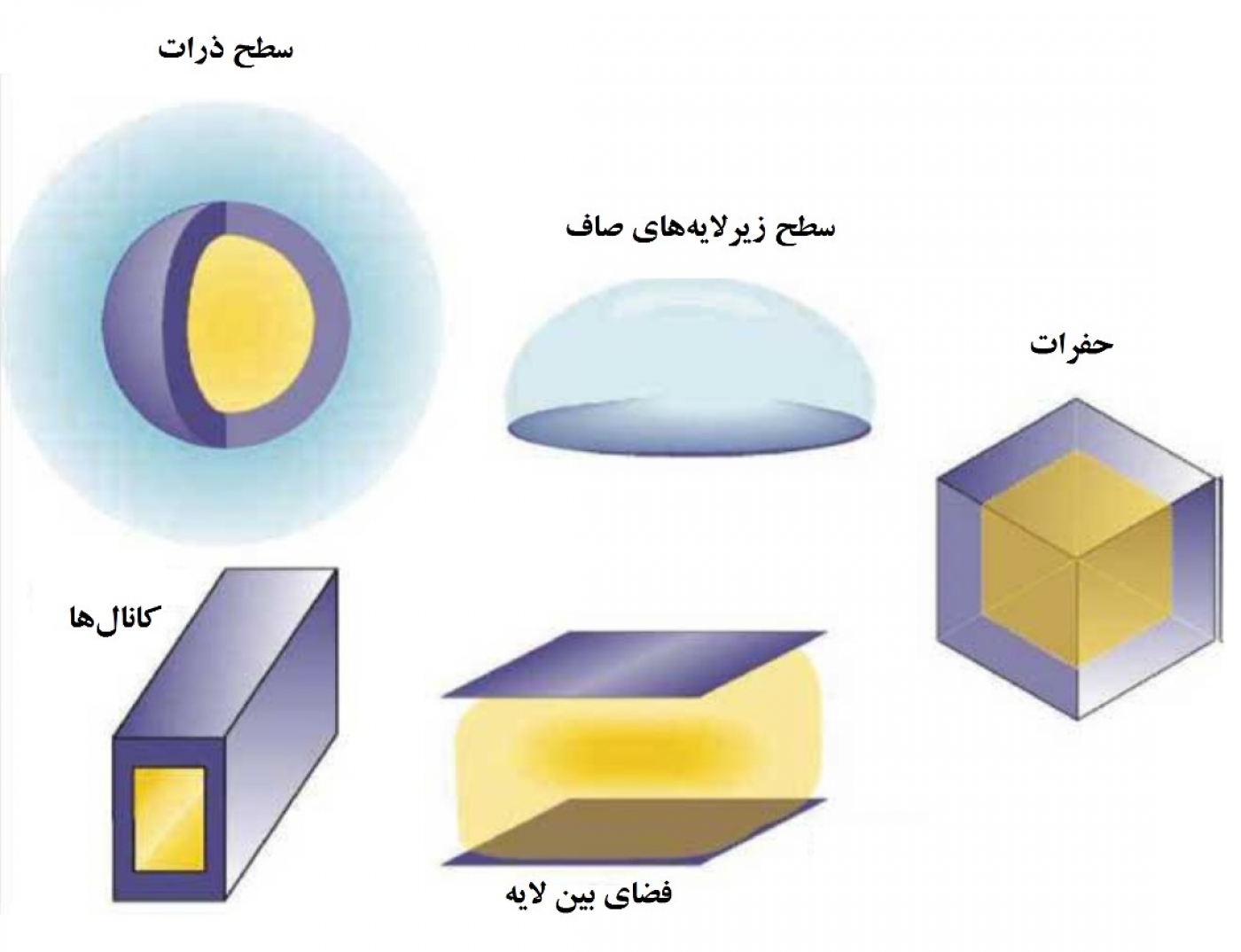
هنگامیکه آرایهای از مولکولها در یک فضای محدود قرار میگیرند، تنشهایی از جانب مولکولهای همسایه و دیوارهها به هر مولکول وارد میشود که این تنشها باعث انحراف ساختار پایدار سینتیکی و ترمودینامیکی مولکول شده و در نهایت منجر به تغییر انرژی واکنشهای شیمیایی در آن میشود. بنابراین، هنگام ورود یک مولکول خارجی (مولکول مهمان) به فضاهای محدود موجود میان آرایهای از مولکولها، این مولکول با مولکولهای موجود برخورد کرده و باعث تغییرات قابل توجهی در جهتگیری (orientation)، برهمکنش (interaction) و انباشتگی (Assembly) آنها میشود. بنابراین، امکان کنترل رفتار مولکولهای مهمان با ایجاد تغییرات و اصلاحاتی در شکل و جنس مواد بهکار رفته در دیواره فضاهای نانوساختار وجود دارد. فضاهایی که توسط اتمها و مولکولهای موجود ایجاد میشود میتوانند بسته به شکل خود، خواص مناسبی ایجاد کنند. در اواخر قرن گذشته میلادی تمرکز اصلی پژوهشگران روی چارچوبهای اَبَرمولکولی بود، اما در قرن بیست و یکم با خلق فضاهایی متنوع، بخش جدیدی از شیمی فضای نانو را معرفی کردند. شکل 1 شمایی از انواع فضاهای نانو را نشان میدهد.
2- نانوساختارهای متخلخل و شیمی اَبَرمولکولی (Supramolecular Chemistry)
طبق مطالب گفته شده، تخلخلهای بسیار ریز در مقیاس نانومتری، نه تنها باعث افزایش چشمگیر نسبت سطح به حجم میشوند، بلکه هر کدام بهتنهایی بهعنوان یک فضای شیمیایی خاص شناخته شده و در تعیین خواص نهایی ماده تأثیر میگذارند. همچنین، این فضای شیمیایی خاص میتواند تأثیر قابل توجهی بر رفتار مولکول خارجی (مهمان) داشته باشد. این پدیده باعث بهوجود آمدن یکی از اساسیترین مباحث در شاخه پیشرفتهای از علم شیمی با عنوان شیمی ابرمولکولها (Supramolecular Chemistry) شده است. شیمی ابرمولکولی به مطالعه مافوق مولکولها میپردازد. بهعبارت دیگر، شیمی ابرمولکولی، یک مولکول منفرد و ساختار خاصی از آن را بررسی نمیکند، بلکه تمرکز اصلی آن روی سیستمهای مولکولی است. سیستمهای مولکولی از تعدادی مجموعه مجزای مولکولی تشکیل میشوند که با یکدیگر برهمکنش دارند. برخلاف مباحث عمومی موجود در شیمی که مبتنی بر پیوندهای کووالانسی است، شیمی ابرمولکولها بیشتر به برهمکنشهای ضعیفتر و غیرکووالانسی بین مولکولها میپردازد. مطالعه برهمکنشهای غیرکوالانسی امکان فهم بسیاری از فرآیندهای زیستی مانند ساختار سلولها و حتی نحوه عملکرد آنها را فراهم میکند. انواع برهمکنشهای غیرکوالانسی موجود در شیمی ابرمولکولها عبارتند از:
· پیوند هیدروژنی؛ که شامل جاذبه بین یک اتم هیدروژن با یک اتم الکترونگاتیو مانند نیتروژن، اکسیژن یا فلوئور است.
· پیوند کئوردیناسیونی؛ که شامل تعدادی مولکول یا آنیون [لیگاند] بهعنوان الکتروندهنده و یک فلز واسطه بهعنوان الکترونگیرنده بوده و طی آن الکترونها بین مواد الکتروندهنده و الکترونگیرنده رد و بدل میشوند.
· نیروی آبگریزی؛ این نیرو به تمایل یک گونه غیرقطبی برای تجمع در محلولهای آبی و حذف مولکولهای آب موجود در میان خود اطلاق میشود.
· نیروهای واندروالس حاصل از جاذبه بین مولکولهای خنثی ناشی از ممانهای دوقطبی موقت یا دائمی آنها.
· برهمکنشهای π-π که شامل نیروی جاذبه غیرکووالانسی بین حلقههای آروماتیک است.
· نیروی الکتروستاتیک که عبارتست از نیروی جاذبه بین بارهای مثبت و منفی مولکولها.
جهت آشنایی بیشتر با شیمی ابرمولکولی به مقاله “شیمی ابرمولکولها” در سایت آموزش نانو مراجعه کنید. شیمی مهمان و میزبان (Host-guest Chemistry) یک مفهوم پرکاربرد در شیمی ابرمولکولی بهشمار میرود و توصیفکننده تعدادی مولکول یا یون است که با ارتباط ساختاری خاص، توسط نیروهای غیرکووالانسی در کنار یکدیگر قرار گرفتهاند. همانطور که پیشتر هم اشاره شد، پیوندهای غیرکووالانسی در حفظ ساختار سهبعدی مولکولهای درشت مانند پروتئینها و همچنین در بسیاری از فرآیندهای زیستی که در آنها مولکولهای درشت بهطور اختصاصی و موقت به یکدیگر متصل میشوند، نقش اساسی و کلیدی ایفا میکنند.
یکی از مطلوبترین راهکارهای سنتز پایین به بالا در ساخت فضاهایی در مقیاس نانو، خودآرایی و خودسازمانی (Self-assembly & Self-organization) شیمیایی و تشکیل پیوندهای کئوردیناسیونی است که در سالهای اخیر بهعنوان یک فناوری جدید در سنتز نانومواد مورد توجه قرار گرفته است. خودانباشتگی، ارتباطی بین علوم شیمی، مواد و بیولوژی پدید آورده است. از لحاظ قدرت پیوند، پیوند کئوردیناسیونی قویتر از پیوند هیدروژنی و ضعیفتر از پیوند کووالانسی است. در پیوند کئوردیناسیونی، اجزای مولکولهای آلی و یونهای فلزی به یکدیگر متصل شده و ساختارهای فضایی سازمان یافته و متنوعی را تشکیل میدهند. به عبارت دیگر، استفاده از این روشها برای طراحی ساختارهایی با فضاهایی با خصوصیات شیمیایی منحصربهفرد صورت میگیرد. چنین فضاهای محدودی امکان مطالعه پدیدههای جدید براساس تجمعات، فشارها و فعالیتهای مولکولی را فراهم میکند. برای پیشرفت در این زمینه، نیاز به گسترش شاخه جدیدی از علم شیمی وجود دارد که امکان کنترل ساختار چنین فضاهایی را فراهم کند. برای مطالعه بیشتر در مورد پیوند کئوردیناسیونی به پیوست 1 در انتهای متن مراجعه کنید. شکل 2 شمایی از عملکردهای مختلف فضاهای بسته را نشان میدهد.
در ادامه به چند مثال برای نشان دادن فضاهایی با قابلیت برهمکنشهای ابرمولکولی پرداخته خواهد شد:
– کریستالهای کئوردیناسیونی با ساختارهای نامحدود؛ این کریستالها از واکنش یونهای فلزی (بهعنوان پذیرنده) با لیگاندهای آلی (بهعنوان رابط) تشکیل میشوند. امکان ساخت فضاهایی با اندازههای مختلف متشکل از تعداد انگشتشمار و حتی دهها مولکول در چنین کریستالهایی وجود دارد.
– سطوح مواد تودهای (Bulk Material) و نانوذرات؛ این سطوح توانایی برهمکنشهای خاص با مولکولها را داشته و از اینرو بهعنوان فضای کئوردیناسیونی مناسب بهشمار میروند.
– فضای کئوردیناسیونی کمپلکسهای فلزی موجود درون پروتئینها؛ این فضاها جز فضاهای کئوردیناسیونی در نمونههای زیستی هستند که تا چندین سال گذشته ناشناخته بودند. بهعنوان مثال، نحوه آرایش یونهای آهن موجود در هموگلوبین امکان واکنش کنترل شده آن با مولکولهای اکسیژن (بهعنوان مولکول مهمان) را فراهم میکند. هموگلوبین یک نوع پروتئین موجود در گلبولهای قرمز خون بوده و نقش آن حمل اکسیژن و دیاکسید کربن است.
3- معرفی برخی از متداولترین ترکیبات متخلخل
فضاهای نانومقیاس موجود در مواد نانومتخلخل به دلیل فراهمسازی بستر مناسب برای استفاده از این مواد در کاربردهای متنوع مانند جداسازی آلایندهها، ذخیرهسازی انرژی و کاتالیستها توجه شیمیدانها، فیزیکدانها و دانشمندان علم مواد را به خود جلب کرده است. از دیدگاه ترکیب شیمیایی، مواد متخلخل به دو دسته آلی و معدنی تقسیمبندی میشوند. مواد متخلخل معدنی شامل زئولیت و چارچوبهای فلزی-آلی، و مواد متخلخل آلی شامل مواد کربنی و پلیمری هستند. البته زئولیتها خود به دو دسته اصلی آلومینوفسفاتها (aluminophosphates) و آلومینوسیلیکاتها (aluminosilicates) تقسیمبندی میشوند. در ادامه بهطور مفصل به بررسی سه ماده نانومتخلخل مشهور شامل کربن فعال، چارچوبهای فلزی-آلی و زئولیت پرداخته میشود.
1-3- کربن فعال
کربن فعال به گروهی از مواد کربنی با تعداد زیاد حفرات ریز با حجم کم اطلاق میشود. بنابراین، مساحت سطح این مواد بسیار زیاد بوده و بهطور گستردهای در جذب سطحی یا واکنشهای شیمیایی مورد استفاده قرار میگیرند. کربن فعال معمولاً از پیرولیز مواد کربنی مانند چوب، زغالسنگ، هسته یا پوسته میوهها مانند پوسته نارگیل بهدست آمده و در مراحل بعدی تحت عملیات فعالسازی قرار میگیرد. پیرولیز مواد کربنی در غیاب هوا، مولکولهای غیرآلی را تخریب کرده و باعث ایجاد ماده پودری کربنی با سطح ویژه بالا و تخلخل زیاد میشود. برای مطالعه بیشتر در مورد “فرآیند پیرولیز” به پیوست 2 مراجعه کنید. امکان اجرای عملیات فعالسازی بعدی با سه روش مختلف وجود دارد که عبارتند از:
· فعالسازی با بخار
· فعالسازی با دیاکسید کربن
· فعالسازی شیمیایی
روش فعالسازی با بخار از لحاظ ملاحظات زیستمحیطی و اقتصادی بهترین گزینه بهشمار میرود؛ در حالیکه روش فعالسازی شیمیایی بیشترین سطح و تخلخل را ایجاد میکند.
نکته جالب توجه اینکه مساحت سطح یک گرم از کربن فعال به دلیل حضور تخلخلهای بسیار ریز، بیش از 500 متر مربع است. یکی از کاربردهای اصلی کربن فعال، در جداسازی بو، رنگ و مزههای نامطلوب از آب مورد استفاده در مصارف خانگی و صنعتی بهدلیل مساحت سطح بالای آن همراه با غنی بودن سطح آن از گروههای عاملی است. از دیگر کاربردهای کربن فعال میتوان به بازیافت حلال، تصفیه هوا، صنایع غذایی و شیمیایی اشاره کرد. شکل 3 تصویری از پودر کربن فعال همراه با تصویر SEM آن را نشان میدهد.
2-3- چارچوبهای فلزی-آلی
چارچوبهای فلزی-آلی (Metal-Organic Frameworks; MOF) ترکیباتی بلوری بوده و از واحدهای یون فلزی یا خوشه (Cluster) معدنی و گروههای آلی به عنوان پیونددهنده (linker) تشکیل شدهاند. چنین اتصالهایی باعث تشکیل ساختارهای یک، دو یا سه بعدی میشود. اتصال این یونهای فلزی یا خوشههای معدنی باعث تشکیل حفرههایی با شکل معین مانند کره یا هشتوجهی میشود. بهعبارت دیگر، چارچوبهای فلزی-آلی از دو جز اصلی تشکیل شدهاند که عبارتند از: (1) یک یون فلزی یا خوشهای از یونهای فلزی و (2) یک لیگاند (Ligand) آلی بهنام پیونددهنده. البته نوع فلز و اتصالدهنده تأثیر بهسزایی روی ساختار و خواص چارچوبهای فلزی-آلی سنتز شده دارد. بهعنوان مثال، تعداد و جهتگیری لیگاندهای اتصالی به فلز مرکزی، تابعی از نوع فلز است. واحدهای آلی پیونددهنده معمولاً لیگاندهای یک، دو، سه یا چهار دندانهای هستند که توانایی برقراری پیوند از یک تا چند سمت را دارند. علاوه بر نوع و ساختار لیگاند، اولویت کئوردیناسیون فلز هم یک عامل مؤثر بر شکل و اندازه حفرات بهشمار میرود. بنابراین، امکان دستیابی به تعداد زیادی از حفرات با ساختار هندسی و عملکرد متفاوت، با تغییر در اتصالات و پیوندهای موجود با فلز واقع در مرکز وجود دارد. شکل 4 شمایی از ساختارهای کوئوردیناسیون مراکز فلزی، اتصالدهنده و پیونددهندهها را نشان میدهد.

پلیمرهای کئوردیناسیونی متخلخل (Porous Coordination Polymer; PCP) یکی از زیرمجموعههای چارچوبهای فلزی-آلی بهشمار میروند. البته، پلیمرهای کئوردیناسیونی از لحاظ قدمت استفاده، بسیار قدیمیتر از چارچوبهای فلزی-آلی هستند. از آنجاییکه اصطلاح پلیمرهای کئوردیناسیونی از واژه پلیمرهای آلی مشتق شده است، میتوان پلیمرهای کئوردیناسیونی را زیرمجموعهای از پلیمرهای هیبریدی معدنی-آلی (Inorganic-organic Hybrid Polymers) هم محسوب کرد. پلیمرهای کئوردیناسیونی آرایهای از مراکز فلزی هستند که توسط لیگاندها (در نقش پل) به یکدیگر متصل شده و یک آرایش بی نهایت از مراکز فلزی را بهوجود آوردهاند. پلیمرهای کئوردیناسیونی متخلخل از یک شبکه نامحدود و مستحکم متشکل از یونهای فلزی بهعنوان اتصالدهنده (Connector) و لیگاندها بهعنوان پیونددهنده (Linker) تشکیل میشوند. طبق تعریفی دیگر، پلیمرهای کئوردیناسون یک ترکیب کئوردینانت (coordination compound) با کئوردینانتهای (مختصات) تکرارشونده در یک، دو یا سهبعد هستند. شکل 5 شمایی از پلیمرهای کئوردیناسونی یک، دو و سهبعدی را نشان میدهد.
3-3- زئولیتها
زئولیتها مهمترین و متداولترین ترکیبات میکرومتخلخل هستند که دارای ساختار منظم بلوری بوده و ساختار آنها حاوی حفرههایی با بار ذاتی منفی است. معمولاً ساختار زئولیتی از شبکه بلوری چهاروجهی (tetrahedral) با چهار اتم اکسیژن در گوشهها و یک اتم مرکزی مثل آلومینیوم، سیلیکون، گالیوم یا فسفر تشکیل میشود. زئولیتها به دو دسته اصلی آلومینوفسفاتها (aluminophosphates) و آلومینوسیلیکاتها (aluminosilicates) تقسیمبندی میشوند. فرمول شیمیایی عمومی زئولیتها به صورت زیر است:
طبق فرمول شیمیایی، ساختار زئولیت حاوی فلزات قلیایی و قلیاییخاکی آبدار است که نقش آنها خنثیسازی بارهای منفی ساختار سیلیکات است. بهدلیل نقص جانشینی Al+3 در مراکز سیلیکونی زئولیتها، چارچوبهای موجود در زئولیتهای طبیعی و مصنوعی (سنتز شده) دارای بار منفی هستند. بنابراین، گونههای با بار مثبت موجود در فضای اضافی حفرات، توازن بار را در زئولیت ایجاد میکنند. در مقایسه با دیگر ساختارهای معرفی شده در این مقاله، فضاهای داخلی موجود در زئولیتها بهطور ذاتی صلبتر بوده و محدودیتهای ساختاری محکمتری را روی مولکولها اعمال کرده و باعث تشکیل حفرات و کانالهای باز میشوند. زئولیتهای متشکل از آلومینوسیلیکات دارای ساختار شبکهای چهاروجهی حاصل از هیبریداسیون sp3 در مرکز سیلیکون بوده و پیوندهای منظم Si-O را تولید میکنند. البته، ساختار اشاره شده تنها ساختار پیشنهادی برای زئولیتهای متشکل از آلومینوسیلیکات نبوده و در سالهای گذشته تعداد زیادی ساختار فضایی برای این نوع زئولیتها پیشنهاد شده است. بهطور کلی، بار و قطبیت چارچوبها بر اساس نسبت سیلیسیوم به آلومینیوم تعیین میشود.
زئولیتهای متشکل از آلومینوسیلیکات بهدلیل قدرت بالای پیوندهای Si-O در آنها، که یکی از قویترین پیوندهای شناخته شده است، پایداری حرارتی، گرمایی و شیمیایی (به جز در برابر اسیدهای قوی) بسیار بالایی دارند. چنین ویژگیهایی منجر به استفاده از این نوع زئولیتها در کاربردهای دما بالا میشود. یکی دیگر از ویژگیهای مطلوب این زئولیتها، تخلخل دائمی آنها است که باعث استفاده روزافزون از آنها در کاتالیستها (مانند شکست کاتالیزوری هیدروکربنها)، تبادلگرهای یونی و مشهای (غربالهای) مولکلولی (molecular sieves) برای جداسازی گاز اکسیژن از نیتروژن میشود. شکل 6 شمایی از گروههای مختلف مواد متخلخل را نشان میدهد.
امکان کنترل ساختار و اندازه حفرات در روشهای مصنوعی (سنتز) زئولیت وجود دارد و میتوان با افزودن ترکیباتی، به حفرههایی با اندازه بیشینه دست یافت. یکی از راهکارها برای دستیابی به حفرات بزرگتر در سنتز زئولیتها، تغییر Si به Al3+/P+5 یا دیگر گونههای جامد چهاروجهی اکسیآنیون همشکل است. البته، پایداری گرمایی زئولیتهای مصنوعی کمتر از زئولیت متشکل از آلومینوسیلیکات است.
نتیجهگیری
مواد نانومتخلخل دارای حفرههایی در ابعاد نانو بوده و سطح ویژه بسیار بالایی دارند. در این مقاله به بررسی نانوساختارهای متخلخل و شیمی ابرمولکولی و همچنین معرفی تعدادی از مواد نانومتخلخل متداول مانند کربن فعال، چارچوبهای فلزی-آلی و زئولیت پرداخته شد. گفته شد هنگامیکه آرایهای از مولکولها در یک فضای محدود قرار میگیرند، تنشهایی از جانب مولکولهای همسایه و دیوارهها به هر مولکول وارد میشود که این تنشها باعث انحراف ساختار پایدار سینتیکی و ترمودینامیکی مولکول شده و در نهایت منجر به تغییر انرژی واکنشهای شیمیایی در آن میشود. اشاره شد که تخلخلهای بسیار ریز در مقیاس نانومتری، نه تنها باعث افزایش چشمگیر نسبت سطح به حجم میشوند، بلکه هر کدام بهتنهایی بهعنوان یک فضای شیمیایی خاص شناخته شده و در تعیین خواص نهایی ماده تأثیر میگذارند. همچنین، این فضای شیمیایی خاص میتواند تأثیر قابل توجهی بر رفتار مولکول خارجی (مهمان) داشته باشد. تأکید شد که شیمی ابرمولکولی، یک مولکول منفرد و ساختار خاصی از آن را بررسی نمیکند، بلکه تمرکز اصلی آن روی سیستمهای مولکولی است. سیستمهای مولکولی از تعدادی مجموعه مجزای مولکولی تشکیل میشوند که با یکدیگر برهمکنش دارند. انواع برهمکنشهای غیرکوالانسی موجود در شیمی ابرمولکولها مانند پیوند هیدروژنی، پیوند کئوردیناسیونی، نیروی آبگریزی و … مورد مطالعه قرار گرفت. گفته شد که از لحاظ قدرت پیوند، پیوند کئوردیناسیونی قویتر از پیوند هیدروژنی و ضعیفتر از پیوند کووالانسی است. در پیوند کئوردیناسیونی، اجزای مولکولهای آلی و یونهای فلزی به یکدیگر متصل شده و ساختارهای فضایی سازمان یافته و متنوعی را تشکیل میدهند. اشاره شد که کربن فعال به گروهی از مواد کربنی با تعداد زیاد حفرات ریز با حجم کم اطلاق میشود. بنابراین، مساحت سطح این مواد بسیار زیاد بوده و بهطور گستردهای در جذب سطحی یا واکنشهای شیمیایی مورد استفاده قرار میگیرند. گفته شد که چارچوبهای فلزی-آلی ترکیباتی بلوری بوده و از واحدهای یون فلزی یا خوشه معدنی و گروههای آلی به عنوان پیونددهنده تشکیل شدهاند. چنین اتصالهایی باعث تشکیل ساختارهای یک، دو یا سه بعدی میشود. تأکید شد که پلیمرهای کئوردیناسیونی متخلخل بهعنوان یکی از زیرمجموعههای چارچوبهای فلزی-آلی، آرایهای از مراکز فلزی هستند که توسط لیگاندها (در نقش پل) به یکدیگر متصل شده و یک آرایش بی نهایت از مراکز فلزی را بهوجود آوردهاند. زئولیتها مهمترین و متداولترین ترکیبات میکرومتخلخل هستند که دارای ساختار منظم بلوری بوده و ساختار آنها حاوی حفرههایی با بار ذاتی منفی است. اشاره شد که ساختار زئولیت حاوی فلزات قلیایی و قلیاییخاکی آبدار است که نقش آنها خنثیسازی بارهای منفی ساختار سیلیکات است.
پیوستها
پیوست 1
پیوند کئوردیناسیون نوعی پیوند غیرکووالانسی بین فلز و لیگاند است که در چنین برهمکنشهایی انتقال الکترون بین یونهای فلزی به عنوان الکترونگیرنده و لیگاندها به عنوان الکتروندهنده رخ میدهد.
پیوست 2
پیرولیز (pyrolysis) یک فرآیند ترموشیمیایی است که طی آن مواد در اثر گرما تجزیه میشوند؛ این فرایند در مواد آلی مرسومتر است. در این فرآیند هم ترکیب شیمیایی و هم فاز فیزیکی بهطور همزمان تغییر میکند؛ بنابراین پیرولیز در دسته فرآیندهای برگشتناپذیر قرار میگیرد.