خودآرایی-2

در این مقاله، برای درک هر چه بهتر فرایند خودآرایی، انواع ساختارهای خودآراییشده، نیروهای درگیر در فرایند و نحوه عمل آنها با نگاه موشکافانهتری مطرح شده است. خصوصیات خودآرایی اتمی، مولکولی، کلوئیدی، زیستی و فصلمشترکی از نظر ساختاری، نیروهای مؤثر بر آنها و مورفولوژی ساختارهای حاصل بیان شده است. در نهایت، موازنه نیروها بهعنوان زیربنای درک فرایند خودآرایی در مقیاسهای نانو تا ماکرو تشریح شده است.
این مقاله شامل سرفصلهای زیر است:
1- درک عمیقتر فرایند خودآرایی
2- خودآرایی از منظر تعادل نیرو
3. طرح کلی برای تشکیل ساختارهای خودآرایی
جمعبندی
1- درک عمیقتر فرایند خودآرایی
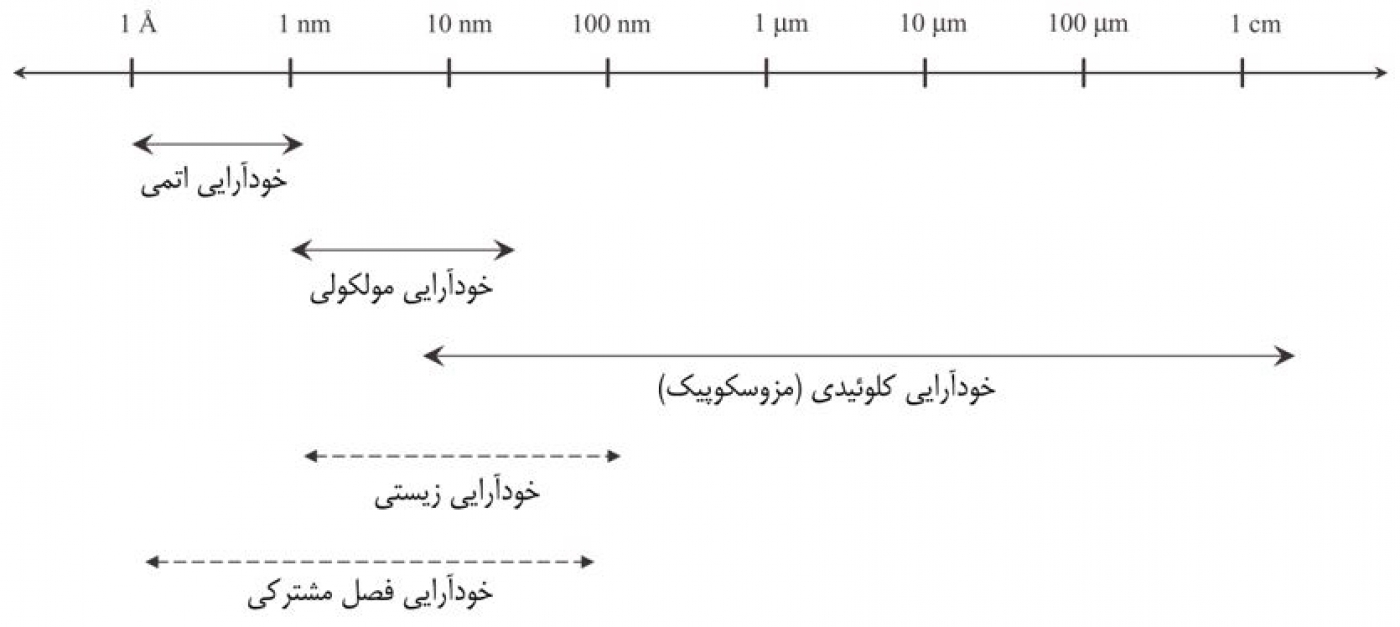
عبارت خودآرایی در واقع دربرگیرنده طیف وسیعی از واحدهای سازنده مواد است و براساس اندازه و ماهیت این واحدهای سازنده، فرایند خودآرایی اتمی، مولکولی و کلوئیدی تعریف میشود. خودآرایی پلیمری نیز زیرمجموعه خودآرایی مولکولی طبقهبندی میشود بهطوری که در آن واحدهای سازنده، مولکولهای پلیمری هستند. پدیدههای تجمع خودبهخودی در سیستمهای بیولوژیکی و زیستی نیز مشاهده شده است. این پدیدهها لزوماً به محلولهای بالک محدود نمیشوند و در سیستمهای دوبعدی مانند سطوح و فصلمشترکها نیز رخ میدهند. سیستمهای زیستی مدتهاست که بهعنوان گنجینهای از فرایندهای جذاب خودآرایی شناختهشده هستند. بسیاری از این موارد شامل فرایندهای تجمع خودبهخودی واحدهای سازنده زیستی از قبیل لیپیدها و اسیدهای آمینه هستند. به جز در مورد پپتیدها و پیوندهای تیولی، پیوندهای کووالانسی کمی در فرایند شرکت میکنند. برای سیستمهای دوبعدی، تجمع خودبهخودی اتمهای فلز یا نیمهرسانا بر روی یک سطح جامد بهصورت درجا [In situ] انجام میشود. علاوهبراین، انواع متعددی از فرایندهای خودآرایی در فصلمشترکهای مختلف گزارش شده است. بنابراین، علاوه بر تقسیمبندی فوق، میتوان فرایندهای خودآرایی را براساس مکان انجام تجمع خودبهخودی در سیستم به دو گروه خودآرایی زیستی و خودآرایی فصلمشترکی تقسیم کرد. شمایی از این تقسیمبندی در شکل 1 نشان داده شده است.
خودآرایی براساس دو معیار زیر تقسیمبندی میشوند:
(1) اندازه یا ماهیت واحدهای سازنده: اتمی، مولکولی و کلوئیدی
(2) محل تجمع خودبهخودی واحدهای سازنده و انجام خودآرایی: زیستی و فصلمشترکی
تقسیمبندی فرایندهای خودآرایی را میتوان براساس ماهیت ترمودینامیکی یا سینتیکی آنها بسط و گسترش داد. فرایندهای خودآرایی اتمی، مولکولی، زیستی و فصلمشترکی دارای ماهیت ترمودینامیکی و خودآرایی کلوئیدی و برخی فرایندهای خودآرایی فصلمشترکی دارای ماهیت سینتیکی هستند. برخی از فرایندهای خودآرایی، تصادفی هستند، حال آنکه فرایندهای دیگر تا حدودی جهتدار هستند. خودآرایی مولکولی، کلوئیدی و فصلمشترکی فرایندهایی تصادفی و برخی از فرایندهای خودآرایی زیستی و اتمی فرایندهایی جهتدار هستند. خودآرایی واحدهای سازنده بزرگ که خودآرایی کلوئیدی نامیده میشود، قادر است نسبت به محرکهای بیرونی از قبیل میدان الکتریکی، میدان مغناطیسی، جاذبه، جریان و مانند آن حساسیت نشان دهد. نمونهای از ریزساختارهای حاصل از فرایندهای خودآرایی اتمی، مولکولی و کلوئیدی در شکل 2 نشان داده شده است.
فرایندهای خودآرایی را میتوان براساس ملاحظات انرژتیکی به دو گروه خودآرایی استاتیکی و خودآرایی دینامیکی تقسیمبندی کرد. خودآرایی استاتیکی در سیستمهایی با تعادل پایدار یا موضعی رخ میدهد. در این خودآرایی هیچگونه اتلاف انرژی طی فرایند خودآرایی وجود ندارد، به این ترتیب که پس از ورود و مصرف انرژی توسط سیستم برای تبدیل آن به سیستم خودآرا، برای منظم نگهداشتن ساختار خودآراییشده نیازی به مصرف انرژی وجود ندارد. تشکیل پروتئینهای کروی و کریستالهای مولکولی مثالهایی از خودآرایی استاتیکی هستند. خودآرایی دینامیکی در سیستمهای غیرتعادلی پایدار روی میدهد. این ساختارهای خودآرا تا زمانی که انرژی بهصورت مداوم مصرف شود، منظم باقی میمانند. به عبارت دیگر، در مورد خودآرایی دینامیکی، اتلاف پیوسته انرژی توسط سیستم مانند یک بافت زنده بدن انسان روی میدهد.
بنابراین، تجمع خودبهخودی در طیف وسیعی از اندازهها از آنگستروم تا سانتیمتر و برای مواد با ابعاد مختلف و منابع و خاستگاههای گوناگون انجام میپذیرد. متداولترین دیدگاه برای یکپارچگی این طیف وسیع، برهمکنش نیروهای بینمولکولی و کلوئیدی است. این برهمکنشها برای تمامی فرایندهای خودآرایی قابلبحث بوده و از منظر تعادل نیرو برای تشکیل سیستمهای خودآراییشده نیز حائز اهمیت است.
2- خودآرایی از منظر تعادل نیرو
خودآرایی بهکمک مواد فعال سطحی به میسلیشدن [Micellization] موسوم است. میسلیشدن به فرایند تشکیل میسلها اطلاق میشود. با در نظر گرفتن نیروهای وارده در طی این فرایند، عملاً این نیروها به سمت موازنه دقیق بین نیروهای جاذبه و دافعه بینمولکولی پیش میروند. نیروهای جاذبه مستقیماً بر روی مولکولهای فعال سطحی عمل کرده و آنها را به یکدیگر نزدیک میسازد، در حالی که نیروهای دافعه در جهت خلاف آن عمل میکند. بنابراین، میتوان نیروهای جاذبه را بهعنوان نیروی محرکه فرایند میسلیشدن و نیروهای دافعه را بهعنوان نیروی مخالف این فرایند تعریف کرد. در طی این فرایند هیچ پیوند شیمیایی مستحکمی مانند پیوند کووالانسی وجود ندارد. به عبارت مشخصتر، نیروی محرکه این فرایند معمولاً نیروی جاذبه آبگریزی و نیروی مخالف آن نیروی دافعه الکترواستاتیکی و یا نیروی حلّالپوشی [Solvation] است. در ابتدا، نیروی آبگریزی بلندبرد برای نزدیککردن مولکولهای فعال سطحی بههمدیگر عمل میکنند. با ادامه فرایند، نیروهای مخالف شامل نیروهای آبپوشی [Hydration] یا دافعه دولایه الکتریکی وارد عمل میشوند. این نیروها برخاسته از گروههای عاملی آبپوشیشده یا حامل بار الکتریکی هستند و در مقایسه با برهمکنشهای آبگریزی، نیروهای نسبتاً کوتاهبردی بهشمار میآیند. این دو نوع نیرو بهصورت تابعی از فاصله بینمولکولی اما در جهات مخالف تغییر میکنند. در نتیجه، نیروهای جاذبه و دافعه بایستی در نقطه مشخصی از فرایند به تعادل برسند. میسلها در این نقطه تشکیل میشوند و رشد بیشتر آنها متوقف میشود. اما از آنجایی که هیچ نوع پیوند شیمیایی در این فرایند ایجاد نمیشود، تبادل مونومرهای فعال سطحی موجود در میسلها با مونومرهای موجود در حجم کل محلول، بسته به خواص دینامیک مولکولی، بهصورت آزادانه صورت میگیرد. غلظت این مونومر برابر با غلظت موردنیاز برای تشکیل اولین میسل (غلظت میسلی بحرانی) است. مقادیر اضافی از مولکولهای فعال سطحی موجود در حجم محلول از روند تعادل نیروی مشابهی پیروی میکند، که در طی آن مقادیر اضافی از میسلها در عین ثابتماندن اندازه آنها تشکیل میشود. غلظت مونومر فعال سطحی در داخل محلول نیز ثابت باقی میماند.
تشکیل میسلهای فعال سطحی تنها سیستمی نیست که در این حیطه از خودآرایی قرار میگیرد. علاوه بر آنها، سوسپانسیونها، امولسیونها و میکروامولسیونهای کلوئیدی نیز سیستمهایی هستند که در آنها برهمکنش مشابهی بین نیروهای دافعه و جاذبه بینمولکولی/کلوئیدی نقش تعیینکنندهای در تشکیل این ساختارهای خودآراییشده دارند.
در مورد سوسپانسیونهای کلوئیدی، هنگامی که نیروهای دافعه بین اجزای کلوئیدی غالب باشد، هیچگونه تجمع و همبستگی بین اجزا ایجاد نخواهد شد. با این حال، زمانی که نیروهای جاذبه غالب باشند، تجمع خودبهخودی صورت میگیرد. حال، نیروی جاذبه واندروالس نیروی محرکه فرایند خودآرایی و برهمکنش دولایه الکتریکی نیروی دافعه مخالف خودآرایی است. خودآرایی نانوذرات با سطوح باردارشده مثال خوبی است. هرگاه سد انرژی پتانسیل بین نانوذرات برطرف شود، تجمع و بههمپیوستن آنها به دلیل جاذبه واندروالس آغاز میشود. اما از آنجایی که نیروی دافعه دولایه الکتریکی بههمراه نیروی واندروالس بهصورت تابعی از فاصله بین نانوذرات حضور دارد، هر عاملی که بتواند منحنی انرژی پتانسیل را تغییر دهد، منجر به تغییر کل فرایند تجمع ذرات میشود. تا زمانی که منبع ثابتی از نانوذرات وجود دارد که با تغییر غلظت الکترولیت یا pH بر این سد انرژی غلبه کند، تجمع نانوذرات تا بهتعادلرسیدن آن توسط نیروی جاذبه یا انرژی حرارتی ادامه مییابد. با توجه به تجمع خودبهخودی نانوذرات بهوسیله تعامل نیروهای بینمولکولی/کلوئیدی، میتوان این فرایند بههمپیوستن را بهعنوان خودآرایی اجزای کلوئیدی در نظر گرفت. با تغییر شرایط به گونهای که باعث غلبه نیروی دافعه دولایه الکتریکی شود، کل فرایند بهطور معکوس پیش خواهد رفت.
امولسیون یا ماکروامولسیون هنگامی تشکیل میشود که دو مایع امتزاجناپذیر (معمولاً آب و روغن) مخلوط شده و با استفاده از ذرات فعال سطحی، پلیمری یا کلوئیدی خودآراییشده در فصلمشترک آب-روغن پایدار شود. از آنجایی که کشش فصلمشترکی در این فصلمشترک هیچگاه به صفر نمیرسد، این سیستم از نظر ترمودینامیکی ناپایدار خواهد بود. پایداری طولانیمدت این سیستم از طریق ایجاد سینتیک بسیار آهسته برای جدایش فازی بهدست میآید. علاوهبراین، خود فرایند خودآرایی برای تشکیل امولسیون بسیار شبیه به تشکیل میکروامولسیون است، بهطوری که برای پلیمرها و مواد فعال سطحی، نیروی محرکه جاذبه برای خودآرایی نیروی آبگریزی و نیروی دافعه مخالف، نیروی دولایه الکتریکی یا نیروی آبپوشی است. نیروی جاذبه و دافعه متداول که در فرایندهای خودآرایی مؤثر هستند، در جدول 1 آمده است.
جدول 1- نیروهای جاذبه و دافعه بینمولکولی/کلوئیدی برای فرایند خودآرایی.
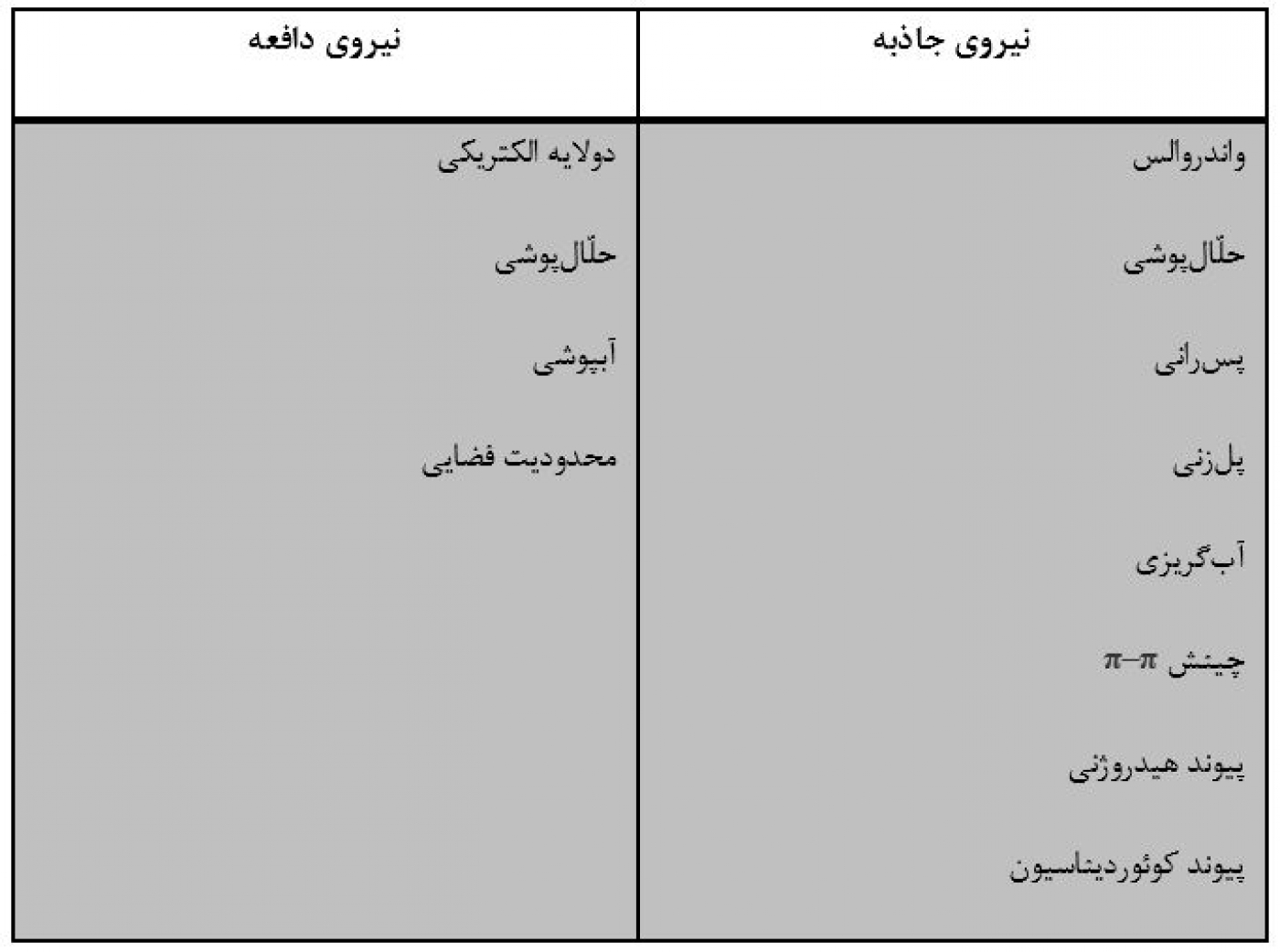
در مورد نیروهای فوقالذکر بایستی به چند نکته توجه کرد:
· در برخی از موارد ممکن است برهمکنش واندروالسی میان اجزای کلوئیدی ناهمسان از نوع دافعه باشد.
· در برخی مواقع، نیروی دولایه الکتریکی میتواند از نوع جاذبه باشد: (1) برهمکنش میان مولکولها یا اجزای کلوئیدی با بار الکتریکی متفاوت رخ دهد، (2) اجزا دارای بار مشابه اما میزان جدایش بسیار کم باشد و (3) برهمکنش میان مولکولها و اجزای کلوئیدی دوباره [Zwitterionic] (یون دو قطبی دارای بار الکتریکی مثبت و منفی) انجام شود.
· پیوند کوئوردیناسیون در مقایسه با نیروهای دیگر، پیوند شیمیایی مستحکمتری است، اما برای برخی از سیستمهای خودآرایی ابرمولکولی بهصورت نیروی جاذبه منحصربهفردی عمل میکند.
سیستمهای زیستی مملو از فرایندهای خودآرایی هستند. غشاهای زیستی، DNA، RNA، آنزیمها و پروتئینها از طریق موازنه دقیق نیرو بین نیروهای جاذبه و دافعه تشکیل میشوند. با این حال، منحصربهفرد بودن این سیستمها در مقایسه با میسلها و کلوئیدها در آن است که تشکیل سیستمهای زیستی خودآراییشده در اغلب موارد با مقداری جهتداری همراه است. به نظر میرشد که جهتداربودن این سیستمهای خودآراییشده و در حالت کلی سیستمهای زیستی، ارتباط نزدیکی با عملکرد منحصربهفرد آنها دارد.
علاوه بر سیستمهای زیستی، بسیاری از سیستمهای زیستتقلیدی مانند سیستمهای حاوی اسیدهای آمینه سنتزی، کربوکسیلیک اسیدها و پلیمرهای شاخهای و حتی ابرمولکولهای گرافیتی غیرزیستی طی فرایندهای خودآرایی جهتدار میشوند. این جهتداری با عملکرد منحصربهفرد آنها نظیر انتقال جرم، رسانایی و فعالیت کاتالیستی ارتباط نزدیک دارد. ساختار مارپیچ جزء ساختارهای خودآراییشده متداول است، اما ساختارهای دیگر از قبیل ساختارهای لولهای، میلهای و حلقهای نیز بهدست آمدهاند.
نیروهای محرکه از نوع جاذبه و نیروهای دافعه مخالف در این فرایندهای خودآرایی جهتدار همواره مشابه نیروهای محرکه و مخالف در فرایندهای خودآرایی غیرجهتدار عمل میکنند. اما دسته دیگری از نیروها در سیستمهای خودآرایی جهتدار وجود دارد که مستقیماً مسئول جهتدار شدن ساختار آنهاست. این نیروها منحصراً بهعنوان نیروی تابعی [Functional force] عمل میکنند. پیوند هیدروژنی و پیوند کوئوردیناسیون جزء متداولترین نیروهای تابعی شناختهشده است. اما نیروهای بسیار ضعیفتر مانند نیروی دافعه فضایی نیز زیرمجموعه نیروهای تابعی هستند. این نیروها میتوانند بخشی از نیروی محرکه یا مخالف طی فرایند خودآرایی باشند، اما در برخی مواقع منحصراً بهصورت نیروی جهتدار عمل میکند.
3. طرح کلی برای تشکیل ساختارهای خودآرایی
براساس مطالب فوق، طرح عمومی برای فرایند خودآرایی که دربرگیرنده تمامی مقیاسها از اتمی تا کلوئیدی باشد، قابل ترسیم است. شکل 3 شمایی از طرح موردنظر را نشان میدهد. خودآرایی فرایند موازنه نیرو بین سه دسته از نیروهاست: نیروی محرکه جاذبه، نیروی دافعه مخالف و نیروی جهتدار. نیروی جهتدار را میتوان بهعنوان نیروی تابعی که مسئول عملکرد ویژه سیستم است، درنظر گرفت. هنگامی که تنها دو دسته اول از این نیروها اعمال شود، خودآرایی بهصورت تصادفی و معمولاً یکمرحلهای انجام میشود. این سیستمهای خودآراییشده ساختار سلسلهمراتبی از خود نشان نمیدهند. بسیاری از فرایندهای خودآرایی مولکولی از قبیل میسلیشدن و بسیاری از سیستمهای کلوئیدی، در این گروه از فرایندهای خودآرایی قرار میگیرند. هرگاه هر سه دسته از نیروهای فوقالذکر بهصورت همزمان وارد عمل شود، فرایندهای خودآرایی جهتدار شده و در بسیاری از موارد بهصورت فرایندهای چندمرحلهای انجام میشوند. این سیستمهای خودآرایی معمولاً ساختار سلسلهمراتبی از خود نشان میدهند. بسیاری از سیستمهای زیستی و زیستتقلیدی جزء این مجموعه از فرایندهای خودآرایی قرار میگیرند.
این دیدگاه ساده را میتوان به سیستمهای دوبعدی پیچیدهتر نیز تعمیم داد. تجمع خودبهخودی اتمهای فلزی یا نیمهرسانا بر روی یک زیرلایه جامد موجب تشکیل تودههای اتمی خودآراییشده مانند نقاط کوانتومی میشود. اندازه نقاط کوانتومی 1 تا 10 نانومتر بوده و مورفولوژی آنها میتواند کروی یا هرمیشکل باشد. این مورفولوژی نتیجه موازنه نیرو عمدتاً بین نیروی جاذبه واندروالس و نیروی دافعه الکترواستاتیک است. میتوان برهمکنش منحصربهفرد اتم-زیرلایه برای این سیستم را بهصورت نیروی جهتدار درنظر گرفت، چرا که این نیرو مسئول دوبعدیبودن این نوع خودآرایی است. رشد همبافته [Epitaxial film growth] لایه نازک نمونه خوبی از این نوع خودآرایی است. برهمکنش اتم-زیرلایه و رونشانی [Epitaxy] زیرلایه قویاً تعیینکننده جهت الگویابی نقاط کوانتومی بوده و تودههای اتمی خودآراییشده دارای ساختاری غیرسلسلهمراتبی است.
اصول مشابهی برای فرایندهای خودآرایی فصلمشترکی بهدست آمده است. میتوان سه نوع فصلمشترک برپایه فاز مایع، یعنی فصلمشترکهای مایع-جامد، مایع-گاز و مایع-مایع را بهعنوان زیرلایه محدود برای خودآرایی فصلمشترکی در دو بعد استفاده کرده و ذرات فعال سطحی، پلیمری و کلوئیدی را در این فضای دوبعدی خودآرایی کرد. در اینجا، نیروهای جاذبه و دافعه مشابه با فرایند خودآرایی در سیستمهای میکروامولسیونی است. مشخصات فصلمشترک از قبیل انرژی فصلمشترکی، نیروی مکانیکی یا برهمکنش واحدهای سازنده با فصلمشترکهای مذکور به عنوان نیروی تابعی عمل میکنند. بنابراین، این فرایند خودآرایی نیز جهتدار و تکمرحلهای بوده و ساختارهای خودآراییشده حاصله اکثراً غیر سلسلهمراتبی هستند. جنبههای ساختاری و واحدهای سازنده معمول هر کدام از سیستمهای خودآرایی بههمراه مثالهایی از تودههای خودآرایی در جدول 2 بهطور خلاصه آورده شده است.
جدول 2- انواع خودآرایی، واحدهای سازنده، مثالهایی از سیستمهای خودآراییشده و مشخصات فرایند خودآرایی.
جمعبندی
در نوشتار حاضر، ابتدا به تقسیمبندی سیستمهای خودآرایی بهعنوان تودههای منظم و بههمپیوسته از اجزای سازنده شامل اتمها، مولکولها، ابرمولکولها و اجزای کلوئیدی پرداخته شد. ساختارهای خودآراییشده از نقطهنظر ظاهری (شکل و اندازه) به انواع مختلف خودآرایی اتمی، مولکولی، کلوئیدی، زیستی و فصلمشترکی تقسیم شد. از دیدگاه انرژتیکی نیز خودآرایی به دو صورت خودآرایی استاتیکی یا دینامیکی تعریف شد. درک بهتر فرایند خودآرایی نیازمند شناخت نیروهای درگیر در انجام خودآرایی، چگونگی برهمکنش ذرات با یکدیگر و مهمتر از همه موازنه میان این نیروهاست. بنابراین، در اینجا، نیروهای درگیر در فرایند و نحوه عمل آنها بهصورت مشروح آورده شد. خصوصیات انواع مختلف خودآرایی از نظر ساختاری، نیروهای مؤثر بر آنها و مورفولوژی ساختارهای حاصل بیان شد و در نهایت، موازنه نیروها بهعنوان زیربنای درک فرایند خودآرایی در مقیاسهای نانو تا ماکرو مورد بررسی قرار گرفت.