آموزش پیشرفتهآموزش نانو
نورگرما درمانی با نانوساختارهای طلا

مطالعات بالینی نشان دادهاند که هایپرترمیا (گرما درمانی) به عنوان روشی برای مقابله با بافتهای سرطانی میتواند مفید باشد، به شرط این که عوارض جانبی کمی داشته باشد. عدم توزیع حرارت در تمامی سلولهای توموری و نیز تیمار حرارتی سلولهای سالم، چالشی است که در بیشتر روشهای هیپرترمیا حتی روشهای هایپرترمیا منطقهای و ناحیهای وجود دارد. نورگرما درمانی (photothermal therapy) به واسطه نانوساختارهای طلا میتواند تا حدودی این مشکل را حل کند، زیرا نانوذرات این توانایی را دارند تا به صورت هدفمند و اختصاصی وارد بافتهای توموری و سلولهای سرطانی شوند و در نتیجه فقط سلولهای سرطانی را تحت تاثیر قرار دهند. در این مقاله، انواع نانوذرات طلای مورد استفاده برای هایپرترمیا، جذب نوری وابسته به شکل و اندازه نانوذرات، نحوه تولید حرارات و نیز سایر پارامترهای مؤثر در درمان فوتوترمال با استفاده از نانوذرات طلا بررسی میشود.
این مقاله شامل سرفصلهای زیر است:
1- مقدمه
2- جذب نور در نانوساختارهای طلا: پدیده تشدید پلاسمون سطحی (Surface Plasmon Resonance)
3- جذب نوری وابسته به اندازه و شکل نانوساختارهای طلا
1-3- نانوذرات کروی طلا
2-3- نانوپوستههای طلا (Gold nanoshells)
3-3- نانومیلههای طلا
4-3- نانوقفسهای طلا
4-مکانیسم فوتوترمال تراپی
5- فوتوترمال تراپی با نانوکرههای طلا
6- فوتوترمال تراپی با نانوپوستههای طلا
7- فوتوترمال تراپی با نانومیلههای طلا
8- فوتوترمال تراپی با نانوقفسهای طلا
9- نتیجهگیری
این مقاله شامل سرفصلهای زیر است:
1- مقدمه
2- جذب نور در نانوساختارهای طلا: پدیده تشدید پلاسمون سطحی (Surface Plasmon Resonance)
3- جذب نوری وابسته به اندازه و شکل نانوساختارهای طلا
1-3- نانوذرات کروی طلا
2-3- نانوپوستههای طلا (Gold nanoshells)
3-3- نانومیلههای طلا
4-3- نانوقفسهای طلا
4-مکانیسم فوتوترمال تراپی
5- فوتوترمال تراپی با نانوکرههای طلا
6- فوتوترمال تراپی با نانوپوستههای طلا
7- فوتوترمال تراپی با نانومیلههای طلا
8- فوتوترمال تراپی با نانوقفسهای طلا
9- نتیجهگیری
1- مقدمه
سلولهای سرطانی به علت سرعت رشد و متابولیسم سریع، نسبت به سلولهای عادی به درمان هایپرترمیا حساستر هستند. به طور کلی چندین روش انتقال انرژی به بدن برای گرم کردن بافتهای بدن وجود دارد که شامل استفاده از میدان الکتریکی، تابش مایکروویو، استفاده از پالسهای الکترومغناطیس، اولتراسوند و نور ناحیه مادون قرمز نزدیک میشود. به دلایل ذکر شده در مقاله قبل (مقدمهای بر هایپرترمیا (گرما درمانی) در درمان سرطان) هنگام استفاده از روشهای فوق برای گرما درمانی، توزیع انرژی در تمامی نقاط تومور یکسان نیست و بافت سالم اطراف تومور نیز آسیب میبیند. استفاده از نانوساختارها به عنوان عواملی که بتوانند به صورت اختصاصی تنها در سلولهای توموری تجمع یابند (رجوع شود به “مقالات دارورسانی به سرطان بر مبنای علم نانو” در مبحث نانوپزشکی) و به عنوان مبدل انرژی (نانو ذرات میتوانند انرژی تابیده شده را به گرما در سلولهای توموری تبدیل کنند) عمل کنند، در سالیان اخیر به شدت مورد توجه بودهاند. نانوساختارهای طلا با جذب نور در ناحیه مرئی و مادون قرمز نزدیک (NIR) و نیز تولید سریع گرما در مدت زمان پیکوثانیه یا کمتر، ابزارهای بسیار خوبی برای تیمار هایپرترمیای سرطان نشان دادهاند. علاوه بر این، نانوساختارهای طلا به عنوان یک عامل کنتراست، ابزار مناسبی برای آشکارسازی سرطان از طریق خواص پراکندگی و فوتولومینسانس نوری در روشهای تصویربرداری سه بعدی درون تن مانند (Optical coherence tomography) OCT و RCM (Reflectance confocal microscopy) هستند.
2- جذب نور در نانوساختارهای طلا: پدیده تشدید پلاسمون سطحی (Surface Plasmon Resonance)
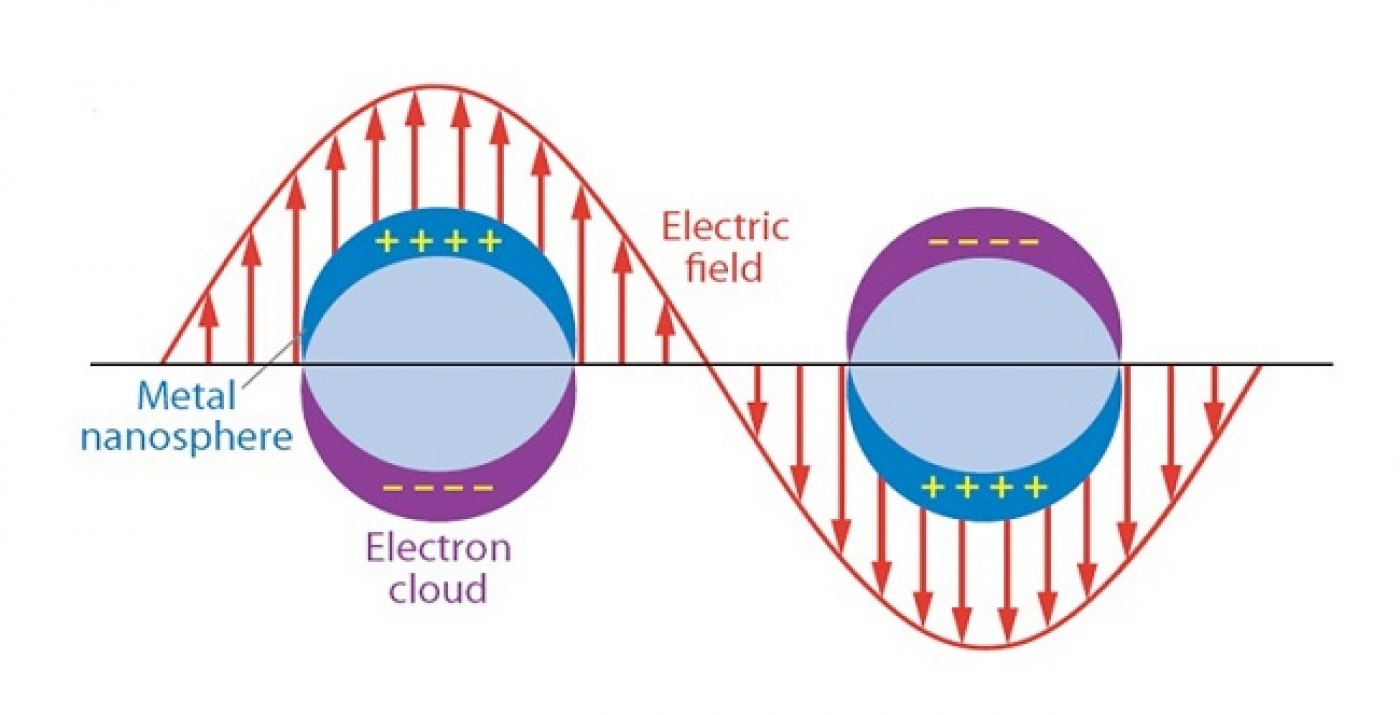
در حضور تابش یک میدان الکترومغناطیسی بر ذره فلزی، الکترونهای رسانش فلزی در پاسخ به بسامد نور فرودی به صورت جمعی شروع به نوسان حول محل تعادل خود میکنند. این نوسان جمعی و همدوس الکترونهای رسانش، پلاسمون سطحی نامیده میشود که وابسته به شکل، اندازه و ترکیب شیمی سطح ذره فلزی است. در واقع این نوسان موجب القای جداسازی بار بین الکترونهای آزاد (بار منفی) و هسته فلزی یونی (بار مثبت) میشود و با اعمال نیروی کولنی بازگرداننده (Restoring Coulomb Force) ، باعث نوسان رو به جلو و عقب الکترونی در سطح ذره میشود که در سادهترین شکل شامل نوسان دوقطبی در نانودرات کروی میشود. در شکل 1 نوسان الکترونی دو قطبی به صورت شماتیک نشان داده شده است.
تشدید بین الکترونهای رسانش و تابش الکترومغناطیسی فرودی، تشدید پلاسمون سطحی نامیده میشود که موجب جذب قوی نور در ناحیه مرئی میشود و در واقع علت ایجاد رنگ محلولهای کلوئیدی نانوذرات فلزی است. این مسأله به صورت کلاسیکی توسط نظریه “می” و با استفاده از معادلات “ماکسول” برای ذرات کروی فلزی توجیه شده است.
تشدید بین الکترونهای رسانش و تابش الکترومغناطیسی فرودی، تشدید پلاسمون سطحی نامیده میشود که موجب جذب قوی نور در ناحیه مرئی میشود و در واقع علت ایجاد رنگ محلولهای کلوئیدی نانوذرات فلزی است. این مسأله به صورت کلاسیکی توسط نظریه “می” و با استفاده از معادلات “ماکسول” برای ذرات کروی فلزی توجیه شده است.
3- جذب نوری وابسته به اندازه و شکل نانوساختارهای طلا
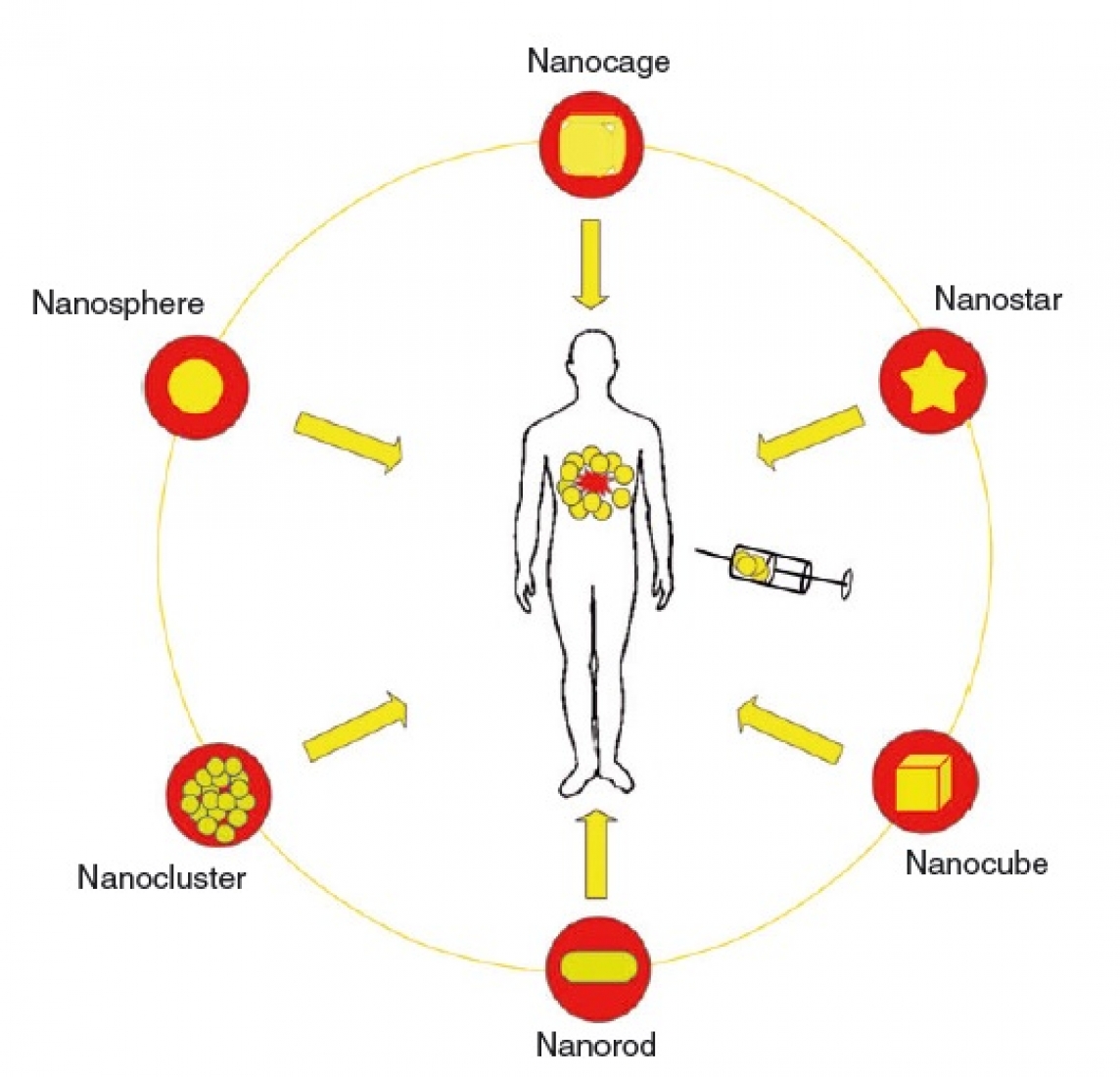
نانوساختارهای طلا در اشکال مختلفی مانند کرهای، میلهای، مکعبیای، مثلثی، ستارهای، قفس مانند و غیره تهیه میشوند (شکل 2). بسته به شکل و اندازه، جذب و پراکندگی نور نانوذرات در ناحیه مرئی و فرابنفش متغیر است. در حال حاضر نانوساختارهای کرهای، میلهای، هسته-پوسته و قفس مانند برای کاربردهای هایپرترمیا به کار گرفته شدهاند که در ادامه به بررسی آنها میپردازیم.
1-3- نانوذرات کروی طلا
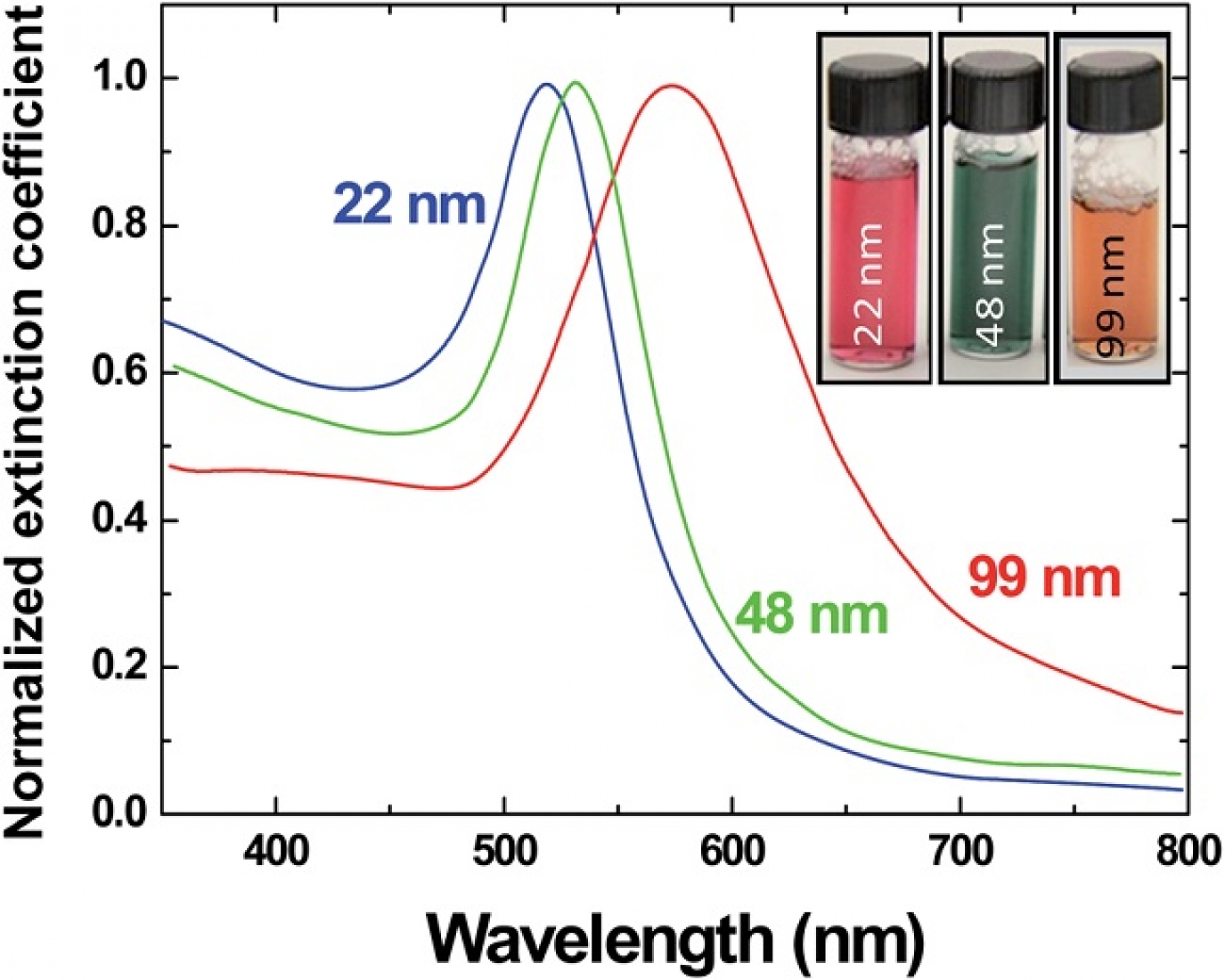
سنتز راحت، تولید در اندازههای بیش از 1 نانومتر تا بالای 100 نانومتر و بیشینه جذب نوری در ناحیه 500 – 600 نانومتر باعث شده است که نانوذرات کروی طلا پرکاربردترین نوع نانوساختارهای طلا باشند. بیشینه طول موج جذبی این ساختارها با افزایش اندازه ذره به طول موجهای بالاتر انتقال داده میشود (شکل3).
2-3- نانوپوستههای طلا (Gold nanoshells)
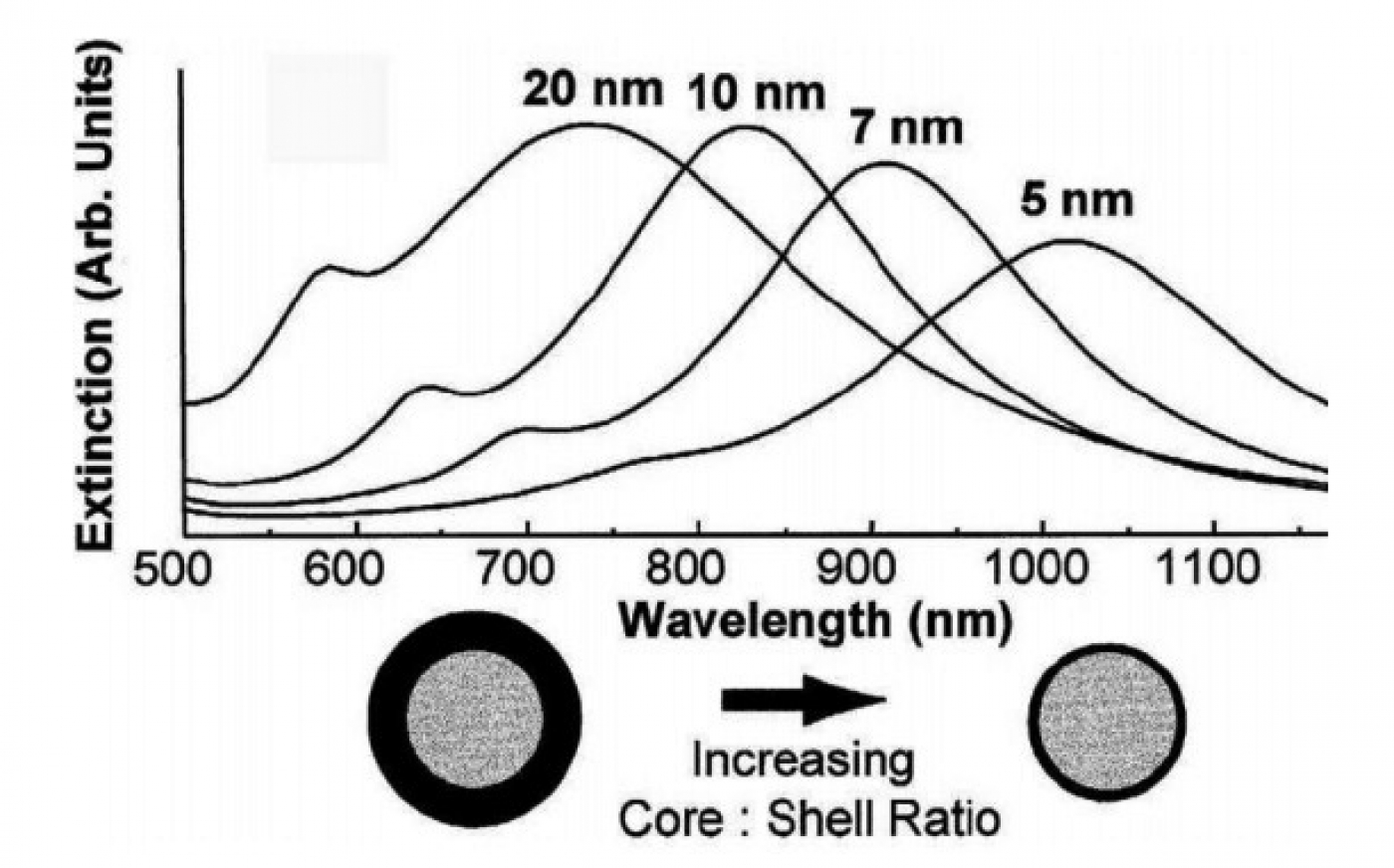
این ساختارها معمولاً کامپوزیتی از طلا و یک دیالکتریک مانند سیلیکا هستند که از هسته سیلیکا و پوسته چند نانومتری طلا تشکیل شدهاند و دارای بیشینه جذب تشدید پلاسمونی در ناحیه مرئی تا ناحیه NIR هستند. برای تهیه این ساختارها بر روی ذرات سیلیکا با گروه آمین، ابتدا نانوذرات کوچک طلا نشانده میشود و در ادامه احیا بیشتر یونهای طلا منجر به ایجاد پوستهای چند نانومتری بر روی هسته سیلیکا میشود. طول موج بیشینه جذبی این نانوذرات به نسبت قطر پوسته طلا به قطر هسته سیلیکا شدیداً وابسته است (شکل 4)، به طوری که با کاهش این نسبت طول موج جذبی به طولموجهای بالاتر در ناحیه NIR انتقال داده میشود که همین امر یعنی جذب در ناحیه NIR باعث جلب توجه به این ساختارها در مطالعات درونتن شده است.
3-3- نانومیلههای طلا
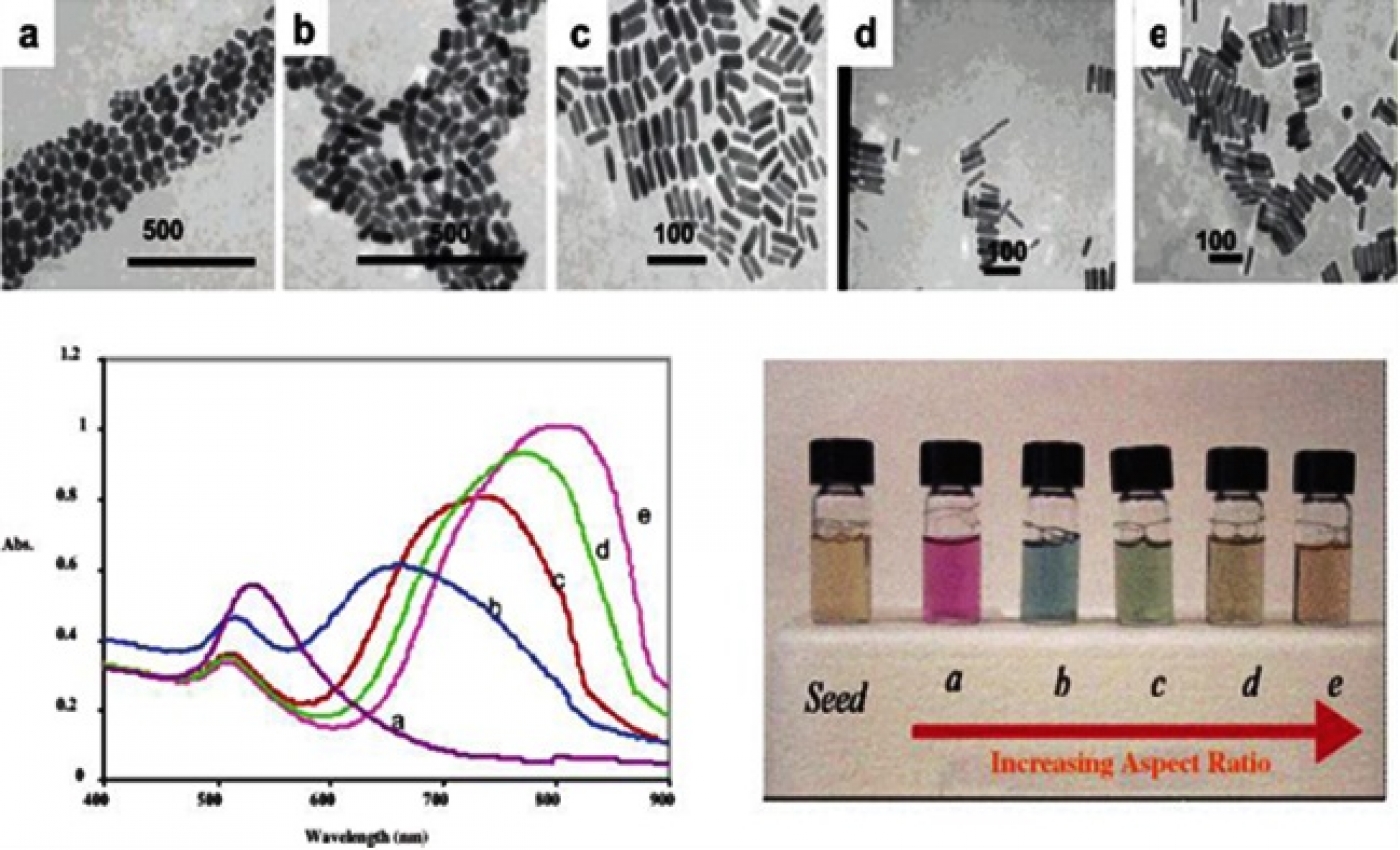
نانومیلههای طلا به علت سطح مقطع نور جذبی بالا (مقدار جذب نور بالا)، جذب قابل کنترل در ناحیه NIR و نیز تحریک فوتولومینسانس قوی دو فوتونی (Two Photon Luminescence) که مناسب تصویربرداری سه بعدی درون تن است، برای کاربردهای هایپرترمیا بسیار مورد توجه هستند. این ساختارها دارای دو بیشینه جذبی هستند که به تشدید پلاسمونهای در عرض نانومیله و تشدید پلاسمونها در طول نانومیله نسبت داده میشوند. فاکتور تعیینکننده در بیشینه جذب مرتبط با تشدید پلاسمونهای طولی، نسبت طول به عرض (aspect ratio) نانومیله است. با تغییر این پارامتر جذب پلاسمونهای طولی نانومیله در ناحیه NIR قابل تنظیم است (شکل 5).
4-3- نانوقفسهای طلا
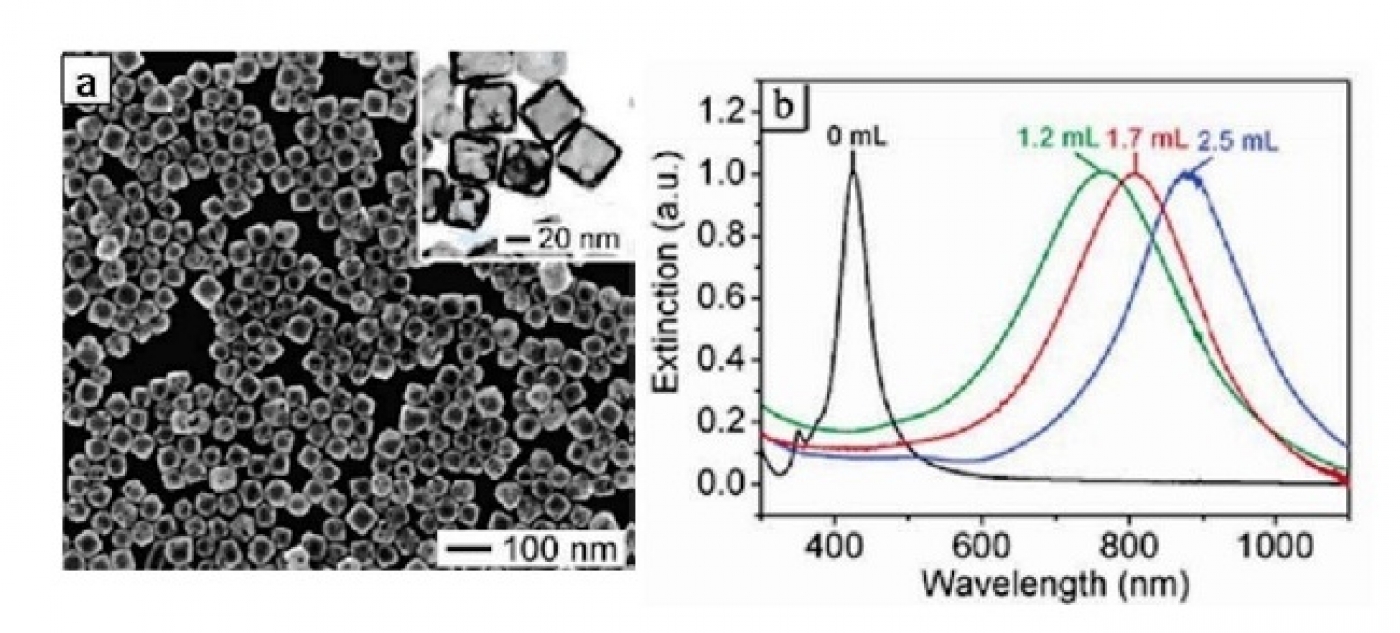
نانوقفسهای طلا از طریق اچ کردن (etching) ساختارهای نانومکعب نقره با نمک کلرید طلا ایجاد میشوند. بنابراین نانوقفسهای طلا ساختارهایی توخالی با دیواره متخلخل، نازک و محکم از طلا هستند (شکل 6a). ضخامت دیواره نانوقفسها از طریق تغییر غلظت کلرید طلای به کارگرفته شده قابل تغییر است که تعیینکننده بیشینه جذب نانوذره است (شکل 6b). با افزایش قطر دیواره طلا هم مقدار و هم طول موج بیشینه جذب افزایش مییابد.
4-مکانیسم فوتوترمال تراپی
عموماً عقیده براین است که سلولهایی که حاوی نانوذرات هستند اگر تحت تابش لیزر قرار بگیرند، نور جذب شده را در چند فمتوثانیه به گرما تبدیل میکنند و این گرما است که موجب مرگ سلولهای سرطانی میشود. نانوساختارهای طلا توسط یک سری پروسههای غیرتابشی نور جذب شده را به حرارت تبدیل میکنند. به صورت کلی پروسه تبدیل نور به انرژی حرارتی از طریق برخوردهای الکترون-الکترون در پلاسمونهای همفاز تحریک شده در کسری از فمتوثانیه شروع میشود و سپس الکترون از طریق برهمکنش الکترون-فونون، انرژی را در مدت زمان تقریبی یک پیکوثانیه به فونونها انتقال میدهد که منجر به ایجاد یک شبکه داغ با افزایش دمای چند ده درجهای میشود. فرایند برهمکنش الکترون-فونون مستقل از شکل و اندازه و حتی پلاسمونهای عرضی یا طولی در نانومیلههای طلا است.
بسته به مقدار انرژی این شبکه داغ، هر کدام از سه فرایند زیر میتواند اتفاق بیافتد:
1) شبکه با انتقال انرژی به محیط اطراف از طریق آسایش فونون-فونون سرد شود (طی مدت زمان تقزیبی 100 پیکوثانیه). این فرایند منجر به گرم شدن محیط اطراف میشود. این تبدیل سریع انرژی به گرما میتواند برای از بین بردن سلولهای سرطانی که نانوذرات در آنها تجمع یافتهاند یا متصل شدهاند، به کار گرفته شود. برای این منظور بایستی از لیزرهای با طول موج نشری نزدیک به طول موج جذبی بیشینه نانوذرات استفاده کرد.
2) اگر سرعت گرمایش بسیار سریعتر از سرعت سرد شدن (سرعت انتقال حرارات به محیط اطراف) باشد، مقدار انرژی حرارتی این شبکه به اندازهای است که باعث تغییرات ساختاری مانند ذوب شدن یا قطعه قطعه شدن نانوساختارهای طلا میشود.
3) مقدار انرژی حرارتی شبکه بعد از تابش با لیزر به اندازهای هست که باعث سوزاندن کل ذره در چند صد فمتوثانیه شود.
برای اینکه بتوانیم از نانوساختارها برای از بین بردن سلولهای سرطانی استفاده کنیم بایستی سعی بر ایجاد شرایطی باشد که پروسه شماره 1 روند غالب باشد. به طور معمول نوع لیزر (طول موج پیوسته یا پالسی) و انرژی و مدت زمان تابش از فاکتورهای تأثیرگذار بر این فرایند هستند.
نانوذرات طلا به خوبی انرژی نوری را به گرما تبدیل میکنند. این امر به دو دلیل اصلی صورت میگیرد که ویژه نانوذرات طلا است. دلیل اول این است که نانوذرات طلا به علت SPR جذب بالایی از نور تابیدهشده دارند و دلیل دوم این است که نور جذب شده به صورت فوتولومینسانس تابش نمیشود و به عبارت دیگر به مقدار بسیار کمی تابش میشود.
بسته به مقدار انرژی این شبکه داغ، هر کدام از سه فرایند زیر میتواند اتفاق بیافتد:
1) شبکه با انتقال انرژی به محیط اطراف از طریق آسایش فونون-فونون سرد شود (طی مدت زمان تقزیبی 100 پیکوثانیه). این فرایند منجر به گرم شدن محیط اطراف میشود. این تبدیل سریع انرژی به گرما میتواند برای از بین بردن سلولهای سرطانی که نانوذرات در آنها تجمع یافتهاند یا متصل شدهاند، به کار گرفته شود. برای این منظور بایستی از لیزرهای با طول موج نشری نزدیک به طول موج جذبی بیشینه نانوذرات استفاده کرد.
2) اگر سرعت گرمایش بسیار سریعتر از سرعت سرد شدن (سرعت انتقال حرارات به محیط اطراف) باشد، مقدار انرژی حرارتی این شبکه به اندازهای است که باعث تغییرات ساختاری مانند ذوب شدن یا قطعه قطعه شدن نانوساختارهای طلا میشود.
3) مقدار انرژی حرارتی شبکه بعد از تابش با لیزر به اندازهای هست که باعث سوزاندن کل ذره در چند صد فمتوثانیه شود.
برای اینکه بتوانیم از نانوساختارها برای از بین بردن سلولهای سرطانی استفاده کنیم بایستی سعی بر ایجاد شرایطی باشد که پروسه شماره 1 روند غالب باشد. به طور معمول نوع لیزر (طول موج پیوسته یا پالسی) و انرژی و مدت زمان تابش از فاکتورهای تأثیرگذار بر این فرایند هستند.
نانوذرات طلا به خوبی انرژی نوری را به گرما تبدیل میکنند. این امر به دو دلیل اصلی صورت میگیرد که ویژه نانوذرات طلا است. دلیل اول این است که نانوذرات طلا به علت SPR جذب بالایی از نور تابیدهشده دارند و دلیل دوم این است که نور جذب شده به صورت فوتولومینسانس تابش نمیشود و به عبارت دیگر به مقدار بسیار کمی تابش میشود.
5- فوتوترمال تراپی با نانوکرههای طلا
نانوذرات کروی طلا نور مرئی را چندین میلیون برابر رنگهای آلی جذب میکنند و نزدیک به 100 درصد نور جذب شده در این ساختارها به حرارت تبدیل میشود. این نانوذرات تحت تابش نور بسیار پایدارند و همچنین زیست سازگاری بالایی دارند. مجموع این موارد و خواص دیگر، این ذرات را یکی از انتخابهای مناسب برای فوتوترمال تراپی معرفی میکند. فوتوترمال تراپی با نانوذرات کروی طلا هم با لیزرهای طول موج پیوسته و هم با لیزرهای پالسی امکانپذیر است. با توجه به جذب SPR این ذرات در ناحیه مرئی (طول موج حدود 500 نانومتر)، کاربرد آنها محدود به سرطانهای سطحی مثل سرطانهای پوستی است و برای سرطانهای عمقی مناسب نیست، چون نور مرئی (طول موج 500 نانومتر) توانایی عبور از بافتهای بدن را ندارد. بنابراین فقط برای تومورهای سطحی که با نور میتوانند تحت تابش قرار بگیرند، کاربرد دارد. اولین مطالعه در این زمینه در سال 2003 انجام شد و مرگ سلولهای سرطانی با 100 پالس لیزر با انرژی 0.5 ژول بر سانتی متر مربع نشان داده شد، در حالی که سلولهای مجاور که فاقد نانوذره بودند ولی تحت تابش لیزر قرار گرفته بودند، زنده مانده بودند. مطالعات مدلسازی نشان داد که دمای سطح نانوذره در هر پالس تابشی لیزر با این توان تا 2000 کلوین بالا میرود و حرارت ایجاد شده تا 15 نانومتر انتقال مییابد.
تحقیقات بعدی با استفاده از لیزرهای پالسی نانوثانیهای (nanosecond pulsed laser) نشان از توان این روش در آسیب منطقهای و انتخابی در محدوده چند نانومتر تا چند میکرومتر، بسته به زمان پالس لیزر و اندازه ذرهای داشت. این امر باعث شد که این روش برای از بین بردن تک تک سلولهای سرطانی در تومورهای میکرومتری مفید باشد. در مطالعه دیگری که توسط السید (El-Sayed) و همکارانش صورت گرفت، نانوذرات 40 نانومتری طلا به آنتی بادی EGFR (فاکتور رشد اپیدرمی) متصل شده و بر علیه سرطانهای سر و گردن به کار گرفته شدند. بعد از 4 دقیقه تابش با لیزر آرگون در طول موج 524 نانومتر در توان 19 وات بر سانتی متر مربع، مرگ سلولهای سرطانی و عدم آسیب سلولهای فاقد نانوذره تحت تیمار مشابه، مشاهده شد.
تحقیقات بعدی با استفاده از لیزرهای پالسی نانوثانیهای (nanosecond pulsed laser) نشان از توان این روش در آسیب منطقهای و انتخابی در محدوده چند نانومتر تا چند میکرومتر، بسته به زمان پالس لیزر و اندازه ذرهای داشت. این امر باعث شد که این روش برای از بین بردن تک تک سلولهای سرطانی در تومورهای میکرومتری مفید باشد. در مطالعه دیگری که توسط السید (El-Sayed) و همکارانش صورت گرفت، نانوذرات 40 نانومتری طلا به آنتی بادی EGFR (فاکتور رشد اپیدرمی) متصل شده و بر علیه سرطانهای سر و گردن به کار گرفته شدند. بعد از 4 دقیقه تابش با لیزر آرگون در طول موج 524 نانومتر در توان 19 وات بر سانتی متر مربع، مرگ سلولهای سرطانی و عدم آسیب سلولهای فاقد نانوذره تحت تیمار مشابه، مشاهده شد.
6- فوتوترمال تراپی با نانوپوستههای طلا
برای درمان تومورهای واقع شده در زیر پوست و تومورهای عمقی، بایستی از نور NIR استفاده کنیم، زیرا این نور کمترین جذب را در هموگلوبین و آب بافتی دارد (رجوع شود به مقالات فوتودینامیک تراپی). بنابراین نانوذرات مورد استفاده بایستی در این محدوده نوری فعال باشند. در سال 2003 اولین مطالعه درون تن و برون تن در ناحیه NIR با نانو پوسته طلا صورت گرفت. در این پژوهش با نانوپوستههای طلا تحت تابش لیزر با طول موج پیوسته (Continuous Wavelength Laser) به مدت زمان 4 دقیقه در ناحیه IR سلولهای سرطان پستان هدف قرار گرفتند و از بین رفتند. با تزریق نانوذرات به داخل تومور و تابش لیزر، تصویربرداری دمایی رزونانس مغناطیسی نشان از افزایش 30 درجهای و ایجاد آسیب بافتی داشت. در مطالعهای دیگر نانوپوستههای مربوطه با پوشش پلی اتیلن گلیکول (PEG) پوشانیده شده و به داخل جریان وریدی تزریق شدند، نانوپوستهها از طریق اثر EPR (اثر افزایش نفوذ و انباشت) در بافت تومور انباشته شده و بعد از تابش ده روزه لیزر، نکروز توموری غیرقابل بازگشت در طی 90 روز مطالعه در موشها مشاهده شد. در کارهای بعدی این ساختار با آنتی بادیها و سایر عوامل هدفگذاری پوشش داده شده و به کار گرفته شد.
7- فوتوترمال تراپی با نانومیلههای طلا
در سال 2006 السید و همکاران با استفاده از نانومیلههای طلا، فوتوترمال تراپی در محیط برون تن را انجام دادند. در این مطالعه نانومیلههای طلای کانژوگه شده به آنتی EGFR به سلولهای سرطان سر و گردن متصل شده و سپس با تابش لیزر موج پیوسته در طول موج 800 نانومتر (بیشینه جذب پلاسمونی نانومیله) به مدت 4 دقیقه تحت تابش قرار گرفته و از بین رفتند . نکته قابل توجه توان لیزر پایین مورد استفاده برای از بین بردن سلولهای سرطانی (w/cm2 10) در مقابل توان بالای مورد نیاز برای از بین بردن سلولهای سالم است (w/cm2 20) که نشانگر هدفگیری مناسب سلولهای سرطانی است، زیرا سلولهای سرطانی بیان بالاتری از EGFR را نسبت به سلولهای سالم دارند. در مقایسه با نانوپوستهها، استفاده از نانومیلهها نیاز به توان 3 برابر کمتر لیزر دارد که به علت جذب بالای نانومیله در ناحیه NIR با طول موج مشابه است. در سالهای اخیر نشان داده شده است که زمانی که نور پلاریزه شده خطی به نور پلاریزهشده مدور تبدیل میشود، جذب نور توسط نانومیله به شدت افزایش مییابد که باعث پایین آمدن 5 برابری آستانه کشتن سلولهای سرطانی میشود.
بررسیهای تئوری نشان داده که انتقال حرارت ایجاد شده از نانومیلهها با شدت لیزر J/cm2 30 باعث افزایش 10 درجهای دمای سلول و در نهایت مرگ سلول از طریق تخریب دیواره سلول میشود. تحقیقات بیشتر نشان داد زمانی که نانومیله به دیواره سلول متصل است، انرژی مورد نیاز برای مرگ سلول 10 بار کمتر از زمانی است که نانومیله وارد سیتوپلاسم شده است. بنابراین نتیجه گرفته شده که مرگ سلولی به علت تخریب دیواره پلاسما و سپس هجوم کلسیم، موجب تخریب فیلامنتهای اکتین و در نهایت آپاپپتوز سلولی (مرگ سلولی) میشود.
بررسیها نشان داده که تزریق داخل وریدی نانومیلههای طلا موجب تجمع بیشتر نانومیلهها در سلولهای سرطانی در مقایسه با تزریق زیرجلدی میشود که کارایی فوتوترمال تراپی با نانومیلههای طلا را افزایش میدهد. نتایج تحقیقات Bhatia نشان داد که تزریق یک بار نانومیلههای پوشیده شده با PEG موجب از بین رفتن کامل سلولهای سرطانی تحت تابش لیزر میشود و تا 50 روز که موشها مورد بررسی قرار گرفتند، هیچ گونه رشد دوباره تومور مشاهده نشد.
بررسیهای تئوری نشان داده که انتقال حرارت ایجاد شده از نانومیلهها با شدت لیزر J/cm2 30 باعث افزایش 10 درجهای دمای سلول و در نهایت مرگ سلول از طریق تخریب دیواره سلول میشود. تحقیقات بیشتر نشان داد زمانی که نانومیله به دیواره سلول متصل است، انرژی مورد نیاز برای مرگ سلول 10 بار کمتر از زمانی است که نانومیله وارد سیتوپلاسم شده است. بنابراین نتیجه گرفته شده که مرگ سلولی به علت تخریب دیواره پلاسما و سپس هجوم کلسیم، موجب تخریب فیلامنتهای اکتین و در نهایت آپاپپتوز سلولی (مرگ سلولی) میشود.
بررسیها نشان داده که تزریق داخل وریدی نانومیلههای طلا موجب تجمع بیشتر نانومیلهها در سلولهای سرطانی در مقایسه با تزریق زیرجلدی میشود که کارایی فوتوترمال تراپی با نانومیلههای طلا را افزایش میدهد. نتایج تحقیقات Bhatia نشان داد که تزریق یک بار نانومیلههای پوشیده شده با PEG موجب از بین رفتن کامل سلولهای سرطانی تحت تابش لیزر میشود و تا 50 روز که موشها مورد بررسی قرار گرفتند، هیچ گونه رشد دوباره تومور مشاهده نشد.
8- فوتوترمال تراپی با نانوقفسهای طلا
اخیراً استفاده از نانوقفسهای طلا برای فوتوترمال تراپی گزارش شده است. در یک مطالعه برونتن بر روی سلولهای سرطانی پستان با نانوقفسهای 40 نانومتری و تابش 5 دقیقهای لیزر با توان W/cm2 6.4 نزدیک به 55 درصد سلولهای سرطانی از بین رفتند. در مطالعه دیگری که با نانوقفسهای 30 نانومتری طلا کانژوگه شده به آنتی EGFR و لیزر با توان 40w/cm2 صورت گرفت، تمامی سلولهای سرطان ملانوما مورد مطالعه از بین رفتند. مطالعات برون تن نیز با نانوقفسهای 43 نانومتری متصل به این آنتی بادی، تخریب کامل فوتوترمال را در پی داشت.
با مقایسه سه ساختار موجود برای فوتوترمال تراپی در ناحیه NIR، نانومیلههای طلا دارای دو مزیت نسبت به نانوقفسها و نانوپوستهها هستند. 1) روند ساخت نانومیلهها بسیار راحت است، با یک پروتکل مناسب تنها در طی دو ساعت در دمای اتاق این ساختارها با نسبت ابعاد مختلف و قابل تنظیم ساخته میشوند. برای ساخت نانوپوستهها ایجاد یک پوسته کاملاً همگن از نظر ضخامت در اطراف هسته سیلیکا بسیار مشکل است و برای ساخت نانوقفسها پروسه ابتدایی ساخت نانومکعبهای نقره نیاز به دمای بالای 150 درجه سیلیسیوس به مدت 20 ساعت دارد.
2) نانومیلههای طلا دارای زمان گردش خونی بالایی هستند که به علت آنیزوتروپی ژئومتری آنهاست. مطالعات اخیر با نانومیلههای پوشانیده شده با PEG نشان از نیمه عمر خونی 17 ساعت در موش دارد. علاوه بر موارد فوق بایستی در نظر داشت که نانوساختارهای میلهای در هنگام اتصال به سلول، به چندین لیگاند سلولی متصل میشوند که باعث تمایل اتصال به سلول بیشتر نسبت به ساختارهای کروی میشود.
با مقایسه سه ساختار موجود برای فوتوترمال تراپی در ناحیه NIR، نانومیلههای طلا دارای دو مزیت نسبت به نانوقفسها و نانوپوستهها هستند. 1) روند ساخت نانومیلهها بسیار راحت است، با یک پروتکل مناسب تنها در طی دو ساعت در دمای اتاق این ساختارها با نسبت ابعاد مختلف و قابل تنظیم ساخته میشوند. برای ساخت نانوپوستهها ایجاد یک پوسته کاملاً همگن از نظر ضخامت در اطراف هسته سیلیکا بسیار مشکل است و برای ساخت نانوقفسها پروسه ابتدایی ساخت نانومکعبهای نقره نیاز به دمای بالای 150 درجه سیلیسیوس به مدت 20 ساعت دارد.
2) نانومیلههای طلا دارای زمان گردش خونی بالایی هستند که به علت آنیزوتروپی ژئومتری آنهاست. مطالعات اخیر با نانومیلههای پوشانیده شده با PEG نشان از نیمه عمر خونی 17 ساعت در موش دارد. علاوه بر موارد فوق بایستی در نظر داشت که نانوساختارهای میلهای در هنگام اتصال به سلول، به چندین لیگاند سلولی متصل میشوند که باعث تمایل اتصال به سلول بیشتر نسبت به ساختارهای کروی میشود.
9- نتیجهگیری
روش هایپرترمیا با نور لیزر بدون استفاده از نانوذرات روشی ناکارآمد و همراه با مشکلات بسیار است. مطالعات بسیاری که با استفاده از نانوذرات طلا صورت گرفته، نشان از آینده درخشان این روش برای درمان سرطان با استفاده از نانوذرات دارد. مطالعات بیشتر برای بهبود روش و امکان به کارگیری در فاز بالینی ضروری است.
منابـــع و مراجــــع
۱ – Huang X, El-Sayed MA. Gold nanoparticles: optical propertiesimplementations in cancer diagnosisphotothermal therapy. Journal of Advanced Research. 2010;1(1):13-28.
۲ – Li J-L, Gu M. Gold-nanoparticle-enhanced cancer photothermal therapy. IEEE Journal of ed topics in quantum electronics. 2010;16(4):989-96.
۳ – Chen PC, Mwakwari SC, Oyelere AK. Gold nanoparticles: nanomedicine to nanosensing. Nanotechnology, scienceapplications. 2008;1:45.
۴ – Henzie, J., M.H. Lee,T.W. Odom, Multiscale patterning of plasmonic metamaterials. Nature Nanotechnology, 2007. 2(9): p. 549-554.
۵ – Sasidharan A, Monteiro‐Riviere NA. Biomedical applications of gold nanomaterials: opportunitieschallenges. Wiley Interdisciplinary Reviews: NanomedicineNanobiotechnology. 2015.